| Login | Einklappen |
| Fotos von Nutzern | Einklappen |
| Nachweis von Chytrid | Einklappen |
Labordiagnostische Nachweismöglichkeiten des Froschpilzes Chytrid (Batrachochytrium dendrobatidis) mit Darstellung einer neuartigen, nicht invasiven Technik von Dr. Tobias Eisenberg, 2007
Der Froschpilz Batrachochytrium dendrobatidis verursacht, sowohl bei in Menschenobhut gehaltenen, als auch bei Amphibien aus Wildbeständen, die mitunter seuchenhaft und verlustreich ablaufende Pilzerkrankung Chytridiomykose. Er gilt als einer der auslösenden Faktoren für das weltweite Amphibiensterben. Der frühzeitige Nachweis dieses Pilzes hat weit reichende Auswirkungen auf den Verlauf der Infektion und die Aussichten einer Therapie. Durch die Erregerdiagnostik lassen sich aber auch Fragen zu Quarantäne, Vergesellschaftung, Abklärung eines Infektionsverdachts oder eines Therapieerfolges, sowie der Klärung des Infektionsstatus von Wildpopulationen beantworten.
Die ersten Testsysteme für den Nachweis von Chytrid bei Amphibien bedienten sich meist histologischer Verfahren (mikroskopische Pathologie am Gewebeschnitt) oder der direkten Mikroskopie am gefärbten Hautabklatschpräparat. Diese Nachweismethoden machen die Diagnose am lebenden Tier nicht selten problematisch und risikobehaftet, denn erforderliche Hautstanzen (Bioptate) lassen sich nur von größeren Arten gewinnen, und das manchmal angewandte Amputieren von Zehen („toe-clipping“) ist unter Aspekten des Tierschutzes als Routineverfahren ungeeignet, verursacht zusätzliche Schmerzen und dadurch eine stressbedingte Beeinträchtigung des Immunsystems und eröffnet zudem weitere Eintrittspforten für Infektionserreger. Darüber hinaus lassen sich nur bei positiven Befunden sichere Schlüsse ableiten. Bei negativen Ergebnissen ist dagegen keine sichere Aussage über die Freiheit von diesem Erreger möglich. Werden dagegen tote Amphibien untersucht, dann sind die Aussagen der klassischen Nachweismethoden sicherer, bringen aber den Nachteil mit sich, dass nur spontan gestorbene oder geopferte Tiere zur Untersuchung gelangen. Dies kann bei kleinen Bestandsgrößen im Rahmen von Erhaltungszuchtprogrammen sowie unter Tier- und Artenschutzaspekten auch nur als unbefriedigend eingestuft werden.
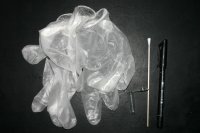
Abb.: Zur Probenentnahme benötigtes Gerät
v. links: sterile Einweghandschuhe ohne Talkum, Kolben, Wattetupfer, Wasserfester Filzstift
© 2007 Tobias Eisenberg

Video: Anleitung zur Probenentnahme
© 2007 Tobias Eisenberg
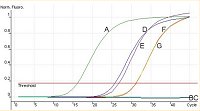
Abb.: Vergleich unterschiedlicher B. dendrobatidis-Erreger-Gehalte mittels qPCR. Gewebeproben aus Froschkadavern und Abstrichen.
A: Positivkontrolle (Reinkultur), B: Negativkontrolle, C: Leerwertkontrolle, D: Gewebeprobe D. auratus mit Chitridiomykose, E: Tupferprobe aus D, F: Gewebeprobe D. tinctorius mit Chitridiomykose, G: Tupferprobe aus F.
© 2007 Tobias Eisenberg
Im Gegensatz dazu sind seit einiger Zeit auch molekularbiologische Verfahren im Einsatz, die erheblich sensitiver (empfindlicher) auch noch kleinste Mengen des Erregers nachweisen können. Neben dem klassischen Probenmaterial können damit erstmals auch Tupferproben von Amphibien auf das Vorhandensein des Froschpilzes untersucht werden. Die Wattetupfer werden, nachdem sie mehrfach über die Bauch- und Unterseite der Extremitäten des Tieres gestrichen wurden, ins Labor geschickt, wo eine starke Vermehrung der gesuchten Froschpilz-Erbsubstanz aus der Probe durchgeführt wird. Durch eine Weiterentwicklung der herkömmlichen Methodik durch das realtime-PCR-Verfahren ließ sich auch die Spezifität steigern, so dass am Ende auch sicher davon ausgegangen werden kann, dass im Falle eines positiven Nachweises ausschließlich Batrachochytrium dendrobatidis und nicht ein anderer, ungefährlicher Erreger, der natürlicher Weise die Amphibienhaut besiedeln kann, nachgewiesen wurde. Ein weiterer Vorteil ist, dass die Menge des abgetupften Erregermaterials quantitativ bestimmt wird, was Aussagen in Bezug auf die Intensität der Infektion zulässt.
Die fortschrittliche Methode wurde kürzlich am Landesbetrieb Hessisches Landeslabor, einem nach ISO 17025 akkreditierten Labor, das sich routinemäßig u. a. mit Tierseuchendiagnostik beschäftigt, etabliert.
Nähere Auskünfte erteilt:
Dr. Tobias Eisenberg
Tel.: 0641-3006777
- Untersuchungsauftrag (pdf)
- Musterformular
Einzusenden an:
Landesbetrieb Hessisches Landeslabor
Dr. T. Eisenberg
Schubertstraße 60 - Haus 13
35392 Gießen
