| Login | Einklappen |
Startseite
Artbeschreibungen
Allobates
Anomaloglossus
Rheobates
Aromobates
Mannophryne
Ameerega
Colostethus
Epipedobates
Silverstoneia
Andinobates
Adelphobates
Dendrobates
Excidobates
Minyobates
Oophaga
Phyllobates
Ranitomeya
Hyloxalus
Foren
Inserate
Reportagen
Service & Links
Einstellungen
| Fotos von Nutzern | Einklappen |
| Nomenklatur | Einklappen |
wissenschaftl. Name: Colostethus panamensis (DUNN, 1933)
Etymologie:
Synonyme:
Colostethus panamensis (GRANT, 2004)
Colostethus inguinalis (SAVAGE, 1968)
Prostherapis inguinalis panamensis (HEATWOLE & SEXTON, 1966)
Phyllobates inguinalis (EVANS, 1947)
Prostherapis panamensis (DUELLMAN, 1966)
Prostherapis inguinalis (BREDER, 1946)
Hyloxalus panamensis (DUNN, 1940)
Hyloxalus fulginosus (DUNN, 1940)
Hyloxalus panamansis (DUNN, 1933)
sensu GRANT, 2004
englischer Name: Common Rocket Frog
deutscher Name: Panama Racketenfrosch
Etymologie:
Das panamensis bezieht sich auf das Hauptverbreitungsgebiet der Art in Panama.
Synonyme:
Colostethus panamensis (GRANT, 2004)
Colostethus inguinalis (SAVAGE, 1968)
Prostherapis inguinalis panamensis (HEATWOLE & SEXTON, 1966)
Phyllobates inguinalis (EVANS, 1947)
Prostherapis panamensis (DUELLMAN, 1966)
Prostherapis inguinalis (BREDER, 1946)
Hyloxalus panamensis (DUNN, 1940)
Hyloxalus fulginosus (DUNN, 1940)
Hyloxalus panamansis (DUNN, 1933)
sensu GRANT, 2004
englischer Name: Common Rocket Frog
deutscher Name: Panama Racketenfrosch
| Systematik | Einklappen |
Klassifizierung:
Amphibia->Anura->Dendrobatoidea->Dendrobatidae->Colostethinae->Colostethus->Colostethus panamensis (DUNN, 1933)
Anmerkung zur Systematik:
Amphibia->Anura->Dendrobatoidea->Dendrobatidae->Colostethinae->Colostethus->Colostethus panamensis (DUNN, 1933)
Anmerkung zur Systematik:
Als lange Zeit unter der Art C. inguinalis . GRANT (2004) zeigte auf, dass es sich bei der Art C. inguinalis um eine in Nordwestkolumbien endemische Art handelt, die nicht mit den Tieren aus Panama identisch ist. Der für die panamaischen Populationen verfügbare Name C. panamensis erhielt wieder Gültigkeit und wurde in den Artrang erhoben.
Achtung!!! Die große Gattung Colostethus enthielt lange Zeit die größte Zahl an Arten innerhalb der Dendrobatidae (FROST, 2004). Ihre Entwicklungslinie innerhalb der Familie Dendrobatidae verlief jedoch nicht linear von einem gemeinsamen Vorfahren aus. Jünste genetischen Untersuchungen von VENCES ET AL. (2003) wiederlegten eine sogenannte e Entwicklung. Stattdessen ließ sich Colostethus s.l. in mindestens fünf verwandschaftlich voneinander unabhängige (paraphyletische) Entwicklungslinien zwischen anderen Gattungen der Familie Dendrobatidae einorden. Eine Aufspaltung von Colostethus s.l. in verschiedene Gattungen und sogar Familien! wurde dann im Zuge der umfangreichen Revision der Dendrobatoidea von GRANT ET AL. (2006) vorgenommen. Die ehemalige Gattung Colostethus s.l. zerfällt nun in die Gattungen Allobates, Aromobates, Anomaloglossus, Manophryne und Rheobates (Fam.: Aromobatidae) und Colostethus, Hyloxalus und Silverstoneia (Fam.: Dendrobatidae).
Achtung!!! Die große Gattung Colostethus enthielt lange Zeit die größte Zahl an Arten innerhalb der Dendrobatidae (FROST, 2004). Ihre Entwicklungslinie innerhalb der Familie Dendrobatidae verlief jedoch nicht linear von einem gemeinsamen Vorfahren aus. Jünste genetischen Untersuchungen von VENCES ET AL. (2003) wiederlegten eine sogenannte e Entwicklung. Stattdessen ließ sich Colostethus s.l. in mindestens fünf verwandschaftlich voneinander unabhängige (paraphyletische) Entwicklungslinien zwischen anderen Gattungen der Familie Dendrobatidae einorden. Eine Aufspaltung von Colostethus s.l. in verschiedene Gattungen und sogar Familien! wurde dann im Zuge der umfangreichen Revision der Dendrobatoidea von GRANT ET AL. (2006) vorgenommen. Die ehemalige Gattung Colostethus s.l. zerfällt nun in die Gattungen Allobates, Aromobates, Anomaloglossus, Manophryne und Rheobates (Fam.: Aromobatidae) und Colostethus, Hyloxalus und Silverstoneia (Fam.: Dendrobatidae).
| Bedrohungsstatus | Einklappen |
Nicht im Anhang II des WA (CITES, 2004). Nicht meldepflichtig nach BArtSchVO. In der Roten Liste (IUCN) aufgrund des großen Verbreitungsgebietes als "nicht gefährdet" gelistet. Keine Handelsbeschränkungen nach CITES (nicht gelistet).
Der Handel und die Terraristik kann den Colostethus-Populationen wohl keinen Schaden zufügen, da sie aufgrund ihrer kryptischen Färbung als wenig attraktiv für Terrarianer gelten. Da viele Arten aber in höheren Lagen entlang von kleinen und mittleren Fliessgewässern vorkommen, dürften diese potentiell durch Chytridiomykosen (Batrachochytridium dendrobatidis) gefährdet sein.
Der Handel und die Terraristik kann den Colostethus-Populationen wohl keinen Schaden zufügen, da sie aufgrund ihrer kryptischen Färbung als wenig attraktiv für Terrarianer gelten. Da viele Arten aber in höheren Lagen entlang von kleinen und mittleren Fliessgewässern vorkommen, dürften diese potentiell durch Chytridiomykosen (Batrachochytridium dendrobatidis) gefährdet sein.
| Beschreibung | Einklappen |
| Größe Mittelgroßer Dendrobatid mit einer von 27-28 mm. |
Brauner Rücken mit Musterung aus dunkelbraunen Flecken. Bauch beim Männchen weiß oder cremefarben, ungezeichnet oder mit feinen, blassen, unregelmäßigem Streifen oder Sprenkeln. Weibchen sind auf dem Bauch dunkler gezeichnet. Haut glatt. Flanken leicht granuliert. Kehle beim Männchen hellweiß, auffällig gesprenkelt oder reticuliert. Kehle der Weibchen eher bräunlich oder grau. Helles . klein (etwa 1/3 des Augendurchmessers) und kaum sichtbar, dunkelbraun. Oberkiefer mit Zähnen. Flanken einfarbig dunkelbraun, mit schrägem blassweißen Lateralstreifen (Flankenstrich) von der Leiste bis zu zur Körpermitte auf Augenhöhe. Kein . Heller . Hinterbeine mit dunklen Querbändern und gelben flecken. Finger mit moderat verbreiterten Fingerscheiben. Dritter Finger auffällig geschwollen. Fingerformel: 2<4<1<3. Zehen ebenfalls mit moderat verbreiterten Scheiben und mit sehr variablen Zehenhäuten. Zehenformel: 1<2<5<3<4. Alle Angaben nach GRANT, 2004.
 Abb.: Dorsal- und Ventralansicht Colostethus panamensis "Portobelo" © 2008 () | Dorsal- und Ventralbild vergleichen: |
Variation:
Aufgrund des großen Verbreitungsgebietes gibt es teilweise beträchtliche Färbungsunterschiede in der Musterung des Rückens und der Kehle. Auch kann die Grundfarbe des s variieren. Allerdings kommen auch innerhalb einer Population beträchtliche Variationen vor, so daß hier keine Varianten benannt werden.
Alter:
Nicht bekannt.
Geschlechtsreife:
WELLS (1980) gibt eine vermutliche Geschlechtreife mit 4-6 Monaten nach der an. Ob die von ihm beobachteten Jungtiere, die im Mai das Wasser verließen, tatsächlich bereits im September erwachsen waren, nur weil keine en Tiere mehr nachweisbar waren bleibt fraglich. Colostethus talamancae wachsen jedenfalls sehr langsam und erreichen erst nach 10 - 12 Monaten die Geschlechtsreife (OSTROWSKI, pers. Beobachtung).
Hautgifte:
Im Gegensatz zu den meisten ungiftigen, kryptisch gefärbten Colostethus-Arten enthält die Haut von C. panamensis , ein starkes Nervengift (DALY ET AL., 1994). DALY konnte mit seinem Forscherteam Konzentrationen von 0,3 - 1,2 µg Toxin pro Froschhaut nachweisen. Die 50 von Tetrodotoxin liegt bei 8 - 20 µg/kg. C. panamensis ist damit die bisher einzige Art innerhalb der Familie Dendrobatidae, die nachgewiesenermaßen trotz er Färbung stark giftig ist. Im Gegensatz zu anderen Dendrobatiden-Giften, die mit kleinen Gliedertieren aufgenommen und angereichert werden (SAPORITO ET AL., 2004), ist die Synthese bzw. Anreicherung von Tetrodotoxin in der Froschhaut noch nicht verstanden. Es handelt sich jedoch möglicherweise um eine Symbiose mit Bakterien, die das Gift produzieren.
| Gelege und Larven | Einklappen |
Merkmale Gelege:
Merkmale Larven:
Entwicklungszeiten:
Ernährung:
Die Gelege umfassen nach HESELHAUS (1988) 20 - 30 Eier.
Merkmale Larven:
Larven von C. panamensis besitzen nur einen kleinen Dottersack. Dennoch wachsen sie auf dem Rücken des Muttertieres während der recht langen Transportzeit noch deutlich. Eine Längenzunahme von bis zu 40% konnte beobachtet werden (WELLS, 1980). Auch viele andere Pfeilgiftfroscharten transportieren ihre Larven über mehrere Tage auf dem Rücken bevor die Larven in abgesetzt werden und meist wachsen die Larven während dieser Zeit deutlich. OSTROWSKI konnte dieses Phänomen z.B. auch bei Dendrobates auratus, Ranitomeya imitator und auch Phyllobates lugubris beobachten. WELLS vermutet, dass die Larven fressen, wenn sich das Weibchen im Wasser befindet um Feuchtigkeit aufzunehmen. Andere Spekulationen gehen dahin, dass sich die Larven von der Haut des Elterntieres ernähren oder von der Haut sogar bestimmte Nährstoffe für die Larvenernährung produziert werden. Es könnte sich aber auch um eine reine Wasseraufnahme und dadurch bedingte Streckung der Zellen handeln, die zum Wachstum der Larven führt. Präzise Beobachtungen bzw. Untersuchungen dieses Phänomens liegen bisher nicht vor.
 Mundfeld Colostethus panamensis nach SAVAGE (1968) © 2007 () Mundfeld vergleichen: |
Wie die Eier der meisten Dendrobatidae benötigen die Eier vermutlich 12-16 Tage je nach Umgebungstemperatur. Jungtiere beenden mit 12-15 mm Kopf-Rumpf-Länge die Metamorphose, wachsen schnell und erreichen nach 4 - 6 Monaten das e Stadium (WELLS, 1980).
Ernährung:
Die Larven sind und ernähren sich in der Natur wohl hauptsächlich von , welcher sich an ruhigeren Stellen im Bach ansammelt. Die Larven sind kaum aggresiv und nicht kannibalistisch veranlagt. Bei künstlicher Aufzucht lassen sich die Larven gut gemeinsam hältern und mit üblichen Zierfischfuttersorten ernähren.
| Verhalten (Ethologie) | Einklappen |
Allgemeines Verhalten:
Revierverhalten:
Balzverhalten:
Brutpflegeverhalten:
Lautäußerung (Vokalisation):
Ruf von Colostethus panamensis, © 2005 T. Ostrowski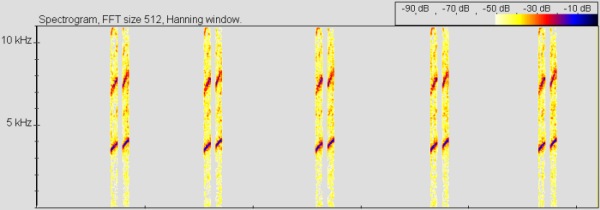
Sonagramm vergleichen:
Die Art ist ausgesprochen (GRANT, 2004). Populationen finden sich nur entlang kleinerer oder mittlerer Bäche. Die Tiere sind tagaktiv. Bei Störungen flüchten sie oft direkt in das Wasser und schwimmen und tauchen recht gut (OSTROWSKI, pers. Beobachtung).
Revierverhalten:
WELLS (1980) dokumentierte ausführlich das interessante Revierverhalten einer Population von C. panamensis über einen Zeitraum von mehreren Monaten. Zusammenfassend werden hier die wichtigsten Erkenntnisse wiedergegeben. Sowohl Weibchen als auch Männchen bilden Reviere und verteidigen diese gegenüber Eindringlingen. Männchen besetzen allerdings größere Reviere als Weibchen. Beide Geschlechter zeigen aggressives Verhalten gegenüber Artgenossen und zwar unabhängig vom Geschlecht. So konnten Weibchen beobachtet werden die Männchen aus ihrem Revier vertrieben, als auch Männchen die nicht e Weibchen durch Klammern und Drücken vertrieben. Die Männchen verteidigen ihre Reviere über den ganzen Tag durch ständiges Rufen in erhöhter Position auf Steinen. Dabei sind die Männchen gut sichtbar und recht auffällig, da ihre meist brilliantweiß gefärbte Schallblase dabei gut sichtbar ist. Diese akkustischen und visuellen Signale dienen der Abwehr von Eindringlingen und dem Anlocken rezeptiver Weibchen. Dringt dennoch ein anderes Tier in das besetzte Gebiet ein, erfolgt die nächste Stufe der Revierverteidigung. Diese zweite Stufe des aggressiven Verhaltens beginnt bei Männchen mit einem Ruf eines bestimmten Types. In den meisten Fällen reicht dieser soggenannte Abwehrruf (encounter call) um den Kontrahenten einzuschüchtern bzw. rezeptive Weibchen zu einer Reaktion zu bewegen. Erst wenn das eindringende Tier nicht das Revier verlässt oder sich nicht als laichwilliges Weibchen zu erkennen gibt, kommt es zu Körperkontakt durch Bespringen. Bei gleich starken Tieren kann es hierbei auch zu Ringkämpfen kommen, bei denen die Tiere versuchen sich gegenseitig vom Stein zu werfen oder den Gegner auf den Boden zu drücken. Revierbesitzende Weibchen verhalten sie sich etwas anders, da sie keinen Abwehrruf produzieren. Sie gehen sofort hoch aufgerichtet auf den Eindringling zu und bespringen ihn meist sofort. Es zeigte sich, dass mehr Weibchen beobachtet werden konnten, die Männchen durch Klammern vertrieben, als Männchen die Weibchen klammerten. Auch interspezifische Aggressionen (Art übergreifend) konnten beobachtet werden. Männliche C. panamensis vertrieben auch männliche Silverstoneia flotator aus ihrem Einflussbereich. Beide Arten zeigen einen sehr ähnlichen Abwehrruf, der wohl zu solchen überartlichen Interaktionen führt. In diesen Beobachtungen zeigt sich gut die Bedeutungen des Rufes bei Anuren um Reviere zu behaupten und unnötigen Körperkontakt zwischen Kontrahenten zu vermeiden.
Interessanterweise änderte sich die Sozialstruktur der von WELLS untersuchten Population im Jahresverlauf. Es besteht ein deutlicher Unterschied zwischen Trocken- und Feuchtperiode. Innerhalb der Trockenperiode sind die Reviere von Männchen und Weibchen auf die direkte Nähe der Restwasser beschränkt. Die Reviere grenzen dann direkt an die Nachbarreviere. Während der Regenzeit nimmt vor allem die Reviergröße der Männchen zu. Diese besetzen dann auch weiter vom Wasser entfernt Reviere, welche auch nicht immer an die Reviere anderer Tiere grenzen. Die Reviere der Weibchen lösen sich demgegenüber auf dem Höhepunkt der Regenzeit teilweise ganz auf. Die Reviere von Männchen und Weibchen scheinen je nach Jahreszeit unterschiedliche Funktionen zu haben. Während die Weibchen und Männchen in der Trockenperiode wohl hauptsächlich Reviere besetzen um Zugang zu Futter und feuchten Rückzugsplätzen zu haben, ändert sich dieses in der Regenperiode deutlich. Während weibliche Reviere eher aufgelöst werden, wachsen die der Männchen in der Größe an. Männchen besetzen Reviere nun, um den Fortpflanzungserfolg zu sichern und Weibchen zu monopolisieren. Weibchen finden nun aber überall Futter und ausreichend Feuchtigkeit und benötigen somit nur noch kleine oder sogar gar keine Reviere mehr.
Interessanterweise änderte sich die Sozialstruktur der von WELLS untersuchten Population im Jahresverlauf. Es besteht ein deutlicher Unterschied zwischen Trocken- und Feuchtperiode. Innerhalb der Trockenperiode sind die Reviere von Männchen und Weibchen auf die direkte Nähe der Restwasser beschränkt. Die Reviere grenzen dann direkt an die Nachbarreviere. Während der Regenzeit nimmt vor allem die Reviergröße der Männchen zu. Diese besetzen dann auch weiter vom Wasser entfernt Reviere, welche auch nicht immer an die Reviere anderer Tiere grenzen. Die Reviere der Weibchen lösen sich demgegenüber auf dem Höhepunkt der Regenzeit teilweise ganz auf. Die Reviere von Männchen und Weibchen scheinen je nach Jahreszeit unterschiedliche Funktionen zu haben. Während die Weibchen und Männchen in der Trockenperiode wohl hauptsächlich Reviere besetzen um Zugang zu Futter und feuchten Rückzugsplätzen zu haben, ändert sich dieses in der Regenperiode deutlich. Während weibliche Reviere eher aufgelöst werden, wachsen die der Männchen in der Größe an. Männchen besetzen Reviere nun, um den Fortpflanzungserfolg zu sichern und Weibchen zu monopolisieren. Weibchen finden nun aber überall Futter und ausreichend Feuchtigkeit und benötigen somit nur noch kleine oder sogar gar keine Reviere mehr.
Balzverhalten:
Auch die hier gemachten Angaben beziehen sich auf die ausführliche Arbeit von WELLS (1980):
Betritt ein Weibchen das Revier eines Männchens so wechselt dieses zunächst seinen Ruftyp vom zum Abwehrruf. Ein es Weibchen verharrt nun oder wendet sich direkt dem Männchen zu. Dieses wechselt daraufhin wieder in den Anzeigeruf und nähert sich bis auf 1 - 2 mm dem Weibchen. Dabei berührt oft die Schallblase während des Rufens das Weibchen. Verharrt das Weibchen weiterhin so umkreist das Männchen das Weibchen mit staksenden Bewegungen, überklettert es sogar und berührt ihren Körper mit den Vorderbeinen. Diese Berührungsphase kann einige Sekunden bis zu mehreren Minuten dauern. Das Männchen entfernt sich schleißlich hüpfend vom Weibchen und wartet rufend in einiger Entfernung bis das Weibchen folgt. Unter ständigem Stoppen und Rufen führt das Männchen das mit etwa 15 cm Abstand folgende Weibchen zum bevorzugten Eiablageort in der Laubschicht oder in feuchten Gesteinsspalten. Dort klettert das Männchen auf das Weibchen, umklammert ihren Kopf mit den Vorderbeinen und presst ihr dabei die Finger unter das Kinn. Dieser sogenannte Kopf ist nur für die Familie Dendrobatidae bekannt. In dieser Stellung geben die Tiere ihre Spermien und Eier ab. Der Paarungserfolg eines Männchens ist offenbar relativ gering. Von 30 beobachteten Zusammentreffen der Geschlechter führte keines zu einer erfolgreichen Paarung. 67% der Treffen endeten mit Flucht des (unrezeptiven?) Weibchens, 11% mit Attacken des Weibchens auf das Männchens. Und in 22% der Fälle ignorierte das Weibchen das Männchen einfach. Offensichtlich sind die Weibchen nur selten rezeptiv und dringen nicht nur mit Paarungsabsichten in das Revier eines Männchens ein. Die Zeit zwischen den Wiederfängen eines erneut Larven tragenden Weibchens war mit 61 - 260 Tagen auch recht hoch und unterstützt diese These.
Die Hauptzahl der Paarungen erfolgte am Cerro Campana zu Beginn der Regenzeit in den Monaten Mai und Juni. Auf dem Höhepunkt der Regenzeit (Juli - Oktober), wenn die Bäche stark strömten gingen die Paarungen zurück. Außer im April kamen jedoch in jedem Monat Paarungen vor.
Betritt ein Weibchen das Revier eines Männchens so wechselt dieses zunächst seinen Ruftyp vom zum Abwehrruf. Ein es Weibchen verharrt nun oder wendet sich direkt dem Männchen zu. Dieses wechselt daraufhin wieder in den Anzeigeruf und nähert sich bis auf 1 - 2 mm dem Weibchen. Dabei berührt oft die Schallblase während des Rufens das Weibchen. Verharrt das Weibchen weiterhin so umkreist das Männchen das Weibchen mit staksenden Bewegungen, überklettert es sogar und berührt ihren Körper mit den Vorderbeinen. Diese Berührungsphase kann einige Sekunden bis zu mehreren Minuten dauern. Das Männchen entfernt sich schleißlich hüpfend vom Weibchen und wartet rufend in einiger Entfernung bis das Weibchen folgt. Unter ständigem Stoppen und Rufen führt das Männchen das mit etwa 15 cm Abstand folgende Weibchen zum bevorzugten Eiablageort in der Laubschicht oder in feuchten Gesteinsspalten. Dort klettert das Männchen auf das Weibchen, umklammert ihren Kopf mit den Vorderbeinen und presst ihr dabei die Finger unter das Kinn. Dieser sogenannte Kopf ist nur für die Familie Dendrobatidae bekannt. In dieser Stellung geben die Tiere ihre Spermien und Eier ab. Der Paarungserfolg eines Männchens ist offenbar relativ gering. Von 30 beobachteten Zusammentreffen der Geschlechter führte keines zu einer erfolgreichen Paarung. 67% der Treffen endeten mit Flucht des (unrezeptiven?) Weibchens, 11% mit Attacken des Weibchens auf das Männchens. Und in 22% der Fälle ignorierte das Weibchen das Männchen einfach. Offensichtlich sind die Weibchen nur selten rezeptiv und dringen nicht nur mit Paarungsabsichten in das Revier eines Männchens ein. Die Zeit zwischen den Wiederfängen eines erneut Larven tragenden Weibchens war mit 61 - 260 Tagen auch recht hoch und unterstützt diese These.
Die Hauptzahl der Paarungen erfolgte am Cerro Campana zu Beginn der Regenzeit in den Monaten Mai und Juni. Auf dem Höhepunkt der Regenzeit (Juli - Oktober), wenn die Bäche stark strömten gingen die Paarungen zurück. Außer im April kamen jedoch in jedem Monat Paarungen vor.
Brutpflegeverhalten:
Bei C. panamensis kümmert sich ausschließlich das Weibchen um die Brutpflege. Es bewässert und bewacht die Gelege etwa 14 Tage. Nach dem Schlupf der Larven setzt sich das Weibchen in die Gallertmasse und alle Larven schlängeln sich auf ihren Rücken (HESELHAUS, 1988). Nach WELLS (1980) transportiert das Weibchen dann die Larven meist gemeinsam in ruhige seichte Bereiche der bewohnten Bäche und nicht in ta. WELLS berichtet von bis zu 40 Larven die gleichzeitig transportiert wurden. Normalerweise sind es jedoch weniger als 35 Quappen. Oft verbleiben die Larven mehrere Tage (bis zu 9 Tage) auf dem Rücken des Muttertieres. Weibchen setzen die Larven nicht immer alle gleichzeitig ab. Die Brutpflege endet nach dem Absetzen der Larven.
Lautäußerung (Vokalisation):
Es handelt sich bei dem Ruf von C. panamensis um einen nach LÖTTERS ET AL. (2003). Der Ruf ist aufgrund der langen Pausen zwischen den Einzeln aber eher als Folge von Einzel- bzw. Mehrfachpfiffen auszumachen und nicht als wirkliches Trillern (vgl. Sound-Datei).
WELLS, (1980) unterscheidet drei Ruftypen:
1. (Advertisement Call) Einzelruf mit 2-5 Noten von 60 ms Dauer und 3200 – 4500 Hz. Diese Einzelpfiffe sind in Rufsequenzen zusammengefasst die hunderten von Einzelrufen enthalten können (Trillern). Dieser Ruftyp dient dem Anlocken der Weibchen und der Revierabgrebzung
2. Abwehrruf (encounter call): Einzellpfiff wie 1. aber etwa 200 ms lang. Dieser Ruftyp dient dazu andere Männchen vom Eindringen ins eigene Revier abzuhalten.
3. Nahbereichsabwehrruf (close-range encounter call): leises Zirpen von etwa 2500 HZ, wird kurz vor dem Kampf von Männchen und! Weibchen abgegeben.
WELLS, (1980) unterscheidet drei Ruftypen:
1. (Advertisement Call) Einzelruf mit 2-5 Noten von 60 ms Dauer und 3200 – 4500 Hz. Diese Einzelpfiffe sind in Rufsequenzen zusammengefasst die hunderten von Einzelrufen enthalten können (Trillern). Dieser Ruftyp dient dem Anlocken der Weibchen und der Revierabgrebzung
2. Abwehrruf (encounter call): Einzellpfiff wie 1. aber etwa 200 ms lang. Dieser Ruftyp dient dazu andere Männchen vom Eindringen ins eigene Revier abzuhalten.
3. Nahbereichsabwehrruf (close-range encounter call): leises Zirpen von etwa 2500 HZ, wird kurz vor dem Kampf von Männchen und! Weibchen abgegeben.
Ruf von Colostethus panamensis, © 2005 T. Ostrowski

Sonagramm vergleichen:
| Lebensraum | Einklappen |
Typenfundort der Erstbeschreibung
Daten von OpenStreetMap - Veröffentlicht unter CC-BY-SA 2.0
Biotop:
Klima:
"El Valle de Anton in der nordwestlichen Ecke der Provinz Panama." (FROST, 2004)
Verbreitung: | 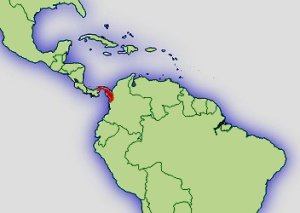 Abb.: Verbreitungsgebiet Colostethus panamensis © 2008 () |
Biotop:
WELLS (1980) Untersuchungsgebiet lag auf 800 m Höhe an den Hängen des Cerro Campana in der Provinz Panama. Die Tiere lebten hier in engen Schluchten entlang steiniger kleiner Bäche. OSTROWSKI (pers. Beobachtungen) besuchte ähnliche Biotope bei dem Ort El Valle de Anton (Typuslokalität). Die Fundorte lagen hier ebenfalls auf etwa 600 - 800 m Höhe. Die Tiere fanden sich auch hier nur entlang kleiner und mittlerer Bäche mit teileise recht hoher Fließgeschwindigkeit. Die Bäche lagen meist beschattet. Die Ufer stiegen recht steil an, und der angrenzende Waldboden war mit Felsen, dichtem Laub und Krautschicht bedeckt. Die Bäche führten zum Teil nach Regenfällen sehr viel Wasser, während sie in der Trockenzeit fast ganz versiegten und nur kleine Tümpel und Rinnsaale übrig blieben, um die sich dann die Tiere konzentrierten. Auch WELLS (1980) machte ähnliche Beobachtungen der Populationsstruktur während Trocken- und Regenzeit.

Abb.: Hochtal von El Valle de Antón. Fundort von Colostethus panamensis, Silverstoneia flotator und S. nubicola. Panama, Provinz Panamá. © 2005 Thomas Ostrowski

Abb.: Hochtal von El Valle de Antón. Fundort von Colostethus panamensis, Silverstoneia flotator und S. nubicola. Panama, Provinz Panamá. © 2005 Thomas Ostrowski
Klima:
Wie auch andere Höhenarten in Mittelamerika kommt auch C. panamensis entlang beider Seiten der Cordilleren vor (siehe auch Oophaga vicentei und O. arborea). Obwohl die Hauptverbreitung auf 600 - 800 m Höhe liegt kommen auch Populationen in höheren Lagen (El Copé, 1200 m) und auch im Tiefland vor (Kanalzone, 350 m). Dadurch sind die Populationen auch unterschiedlichem Klima ausgesetzt. Während in tieferen Lagen kaum Tagesschwankungen (2-3° C) und fast keine Jahresschwankungen der Temperatur vorliegen, kann es in höheren Lagen durchaus in klaren Nächten zu Temperaturabfällen von 10° C kommen. Da die Tiere an schattigen meist kühlen Bächen (20 - 22° C) leben sind sie selten Lufttemperaturen von über 24° C ausgesetzt. Tieflandpopulationen leben bei max. 25 - 26 °C. Die Luftfeuchte ist entlang Wasser führender Bäche sehr hoch (98%) und recht konstant. Auf den pazifischen Seiten kommt es allerdings von November bis April zu einer ausgeprägten Trockenperiode, in denen die Bäche teilweise ganz versiegen. Nun steigen die Temperaturen auch etwas an und die Luftfeuchte sinkt. Die Tiere ziehen sich nun an den Rand der Gewässer zurück und schränken auch ihre Rufaktivität etwas ein (WELLS, 1980).
 Abb.: Pazifisch beeinflusstes Klima der mittleren Lagen mit Trockenperiode. Quelle: Instituto Geografico Tommy La Guardia. | 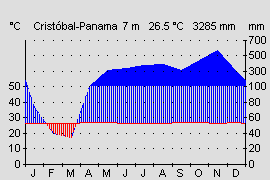 Abb.: Atlantisch beeinflusstes Klima des Tieflandes mit kurzer Trockenperiode. Quelle: Instituto Geografico Tommy La Guardia. |
| Haltung im Terrarium | Einklappen |
Terrarium/Einrichtung:
Temperaturen:
Luftfeuchte:
Ernährung:
Besatz:
Tipps zur Zucht:
Varianten in Terrarienhaltung:
Regenwald-Terrarium ab 70 cm x 50 cm x 50cm. Automatische Beregnung und Nebelanlage empfehlenswert. C. panamensis ist ein Bodenbewohner und klettert kaum. Ein Wasserteil und ein kleiner Wasserlauf mit mittelgroßen Steinen (Durchmesser 10 cm) sollten vorhanden sein. Die Männchen sitzen gern erhöht auf den Steinen im Wasser von wo aus sie auch rufen. Einrichtung mit Wurzeln und Steinen. Dichte Bepflanzung mit Farnen Moosen und Rankpflanzen. Einige Laichplätze in Form von Fotodosen oder Laichhäuschen sollten vorhanden sein.
Temperaturen:
C. panamensis kann je nach Höhenlage bei 22 – 26 ° C Lufttemperatur gehalten werden. Da die Tiere direkt am kühlen Wasser leben und auch eher in den höheren Lagen vorkommen lieber nicht zu warm halten. Die Wassertemperatur sollte bei 20 - 24 ° C liegen. Eine Nachtabsenkung von 2-4 ° C ist empfehlenswert.
Luftfeuchte:
Die Luftfeuchtigkeit ist aufgrund des Lebensraumes am fließenden Wassers sehr hoch. 95% - 100%. Ein Wasserlauf bringt ein ausreichend feuchtes Klima ins Terrarium.
Ernährung:
Übliche kleine und mittlere Futtertiere wie Drosophila, Mikro-Heimchen (auch etwas größere), Springschwänze und Wiesenplankton. Gezüchtete Futtertiere sollten regelmäßig vitaminisiert werden, z.B. mit Amivit A nach der Rezeptur von BIRKHAHN (1991).
Besatz:
Gute Ergebnisse mit 2,1. In größeren Becken auch größere Gruppen. Das Verhalten der Männchen untereinander ist sehr interessant wobei jedem Tier ein eigener Stein zu Verfügung stehen sollte. Mehrere rufende Männchen sind für die Laichstimulans des Weibchens von Vorteil.
Tipps zur Zucht:
Die Eiablage erfolgt auf glatten Steinen oder Pflanzenblättern meist etwas geschützt. Die Tiere benutzen auch gerne Laichhäuschen und Fotodosen. Die Tiere betreiben Brutpflege und transportieren immer ausreichend Quappen in den Wasserteil. Legt man Wert auf eine große Anzahl Larven sollte man die Eier früh entfernen und in etwas Wasser in Petrischalen zeitigen. Die Larven sind nicht aggressiv und können in kleinen Aquarien bei Temperaturen von 20-24 ° C gemeinsam aufgezogen werden. Sie lassen sich sehr gut mit Zierfischtrockenfutter aufziehen. Dabei sollte man Sorten wählen die vermehrt pflanzliche Inhaltsstoffe beinhalten. Besonders beliebt sind Kaninchenpellets aber auch Katzen-Trockenfutter kann verwendet werden (Achtung! höhere Wasserverschmutzung). Die Jungtiere sind sehr klein, fressen aber schon kleine Drosophila. Sie sind die ersten Wochen etwas empfindlich gegenüber Umsetzen und zu hohen Temperaturen.
Varianten in Terrarienhaltung:
| Holotyp |  |
Daten errechnet aus von Nutzern gemeldeten Fröschen (Home->Meine Frösche) und den aktuellen Inseraten.
stand 29.02.2024 19:51 Uhr
stand 29.02.2024 19:51 Uhr
| Autoren dieser Seite: | Einklappen |
| Referenzen | Einklappen |
BIRKHAHN, H. (1991): Neue Erkenntnisse über die Aminosäureversorgung bei Dendrobatiden.
XX- herpetofauna, Weinstadt, 13 (74): 23-28.
DALY, J. W., F. GUSOVSKY, C.W. MYERS, M. YOTSU-YAMASHITA & T. YASUMOTO (1994):
XXFirst occurrence of Tetrodotoxin in a Dendrobatid Frog (Colostethus inguinalis),with further
XXreports for the Bufonid Genus Atelopus. - Toxicon 32(3): 279-285.
FROST, D.R. (2007): Amphibian Species of the World: an Online Reference. Version 5.0 (1.02.2007).
XXElectronic Database accessible at http://research.amnh.org/herpetology/amphibia/index.php
XX Am.Mus.Nat.Hist. New York, USA.
GRANT, T . , FROST, D. R. , CALDWELL, J. P. , GAGLIARDO, R. , HADDAD, C. F. B. , KOK, P. J. R. ,
XXMEANS, D.B. , NOONAN, B. P. , SCHARGEL, W. E. & W.C. WHEELER (2006): Phylogenetic
XXsystematics of dart-poison frogs and their relatives (Amphibia, Athesphatanura, Dendrobatidae).
XX - Bulletin of the Am.Mus.Nat.Hist. 299. (PDF)
GRANT, T. (2004): On the Identities of Colostethus inguinalis (Cope, 1868) and C. panamensis
XX(Dunn, 1933), with Comments on C. latinasus (Cope, 1863) (Anura: Dendrobatidae)
XX- Am.Mus.Nov. 3444: 1-24
HESELHAUS, R. (1988): Pfeilgiftfrösche. 2., überarbeitete Auflage - Stuttgart, Ulmer: 90 - 91.
IUCN, Conservation International, and NatureServe. (2009): Global Amphibian Assessment.
XXwww.globalamphibians.org. Downloaded on 15 October 2004.
RIVERO, J. & M.A. SERNA (1988): La identificacion de los Colostethus (Amphibia, Dendrobatidae)
XXde Colombia. - Caribbean Journal of Science, Vol. 24, No. 3-4: pp.137-154
SAPORITO, R.A., GARRAFFO, H.M., DONNELLY, M.A. , EDWARDS, A.L., LONGINO, J.T., & J.W. DALY (2004):
XXFormicine ants: An arthropod source for the pumiliotoxin alkaloids of dendrobatid poison frogs.
XX- Proc.Nat.Acad.Sci USA 101 (21):8045-8050
VENCES, M. , KOSUCH, J. , BOISTEL, R. , HADDAD, C.F.B. , LA, MARCA, E. , LÖTTERS, S. & M. VEITH (2003): Convergent evolution of aposematic coloration in Neotropical poison frogs: a molecular
XXphylogenetic perspective. - Org. Divers. Evol. 3: 215 - 226. (PDF)
WELLS, K.D. (1980): Behavioral Ecology an Social Organization of a Dendrobatid Frog
XX(Colostethus inguinalis). - Behav. Ecol. Sociobiol. 6, 199-209
XX- herpetofauna, Weinstadt, 13 (74): 23-28.
DALY, J. W., F. GUSOVSKY, C.W. MYERS, M. YOTSU-YAMASHITA & T. YASUMOTO (1994):
XXFirst occurrence of Tetrodotoxin in a Dendrobatid Frog (Colostethus inguinalis),with further
XXreports for the Bufonid Genus Atelopus. - Toxicon 32(3): 279-285.
FROST, D.R. (2007): Amphibian Species of the World: an Online Reference. Version 5.0 (1.02.2007).
XXElectronic Database accessible at http://research.amnh.org/herpetology/amphibia/index.php
XX Am.Mus.Nat.Hist. New York, USA.
GRANT, T . , FROST, D. R. , CALDWELL, J. P. , GAGLIARDO, R. , HADDAD, C. F. B. , KOK, P. J. R. ,
XXMEANS, D.B. , NOONAN, B. P. , SCHARGEL, W. E. & W.C. WHEELER (2006): Phylogenetic
XXsystematics of dart-poison frogs and their relatives (Amphibia, Athesphatanura, Dendrobatidae).
XX - Bulletin of the Am.Mus.Nat.Hist. 299. (PDF)
GRANT, T. (2004): On the Identities of Colostethus inguinalis (Cope, 1868) and C. panamensis
XX(Dunn, 1933), with Comments on C. latinasus (Cope, 1863) (Anura: Dendrobatidae)
XX- Am.Mus.Nov. 3444: 1-24
HESELHAUS, R. (1988): Pfeilgiftfrösche. 2., überarbeitete Auflage - Stuttgart, Ulmer: 90 - 91.
IUCN, Conservation International, and NatureServe. (2009): Global Amphibian Assessment.
XXwww.globalamphibians.org. Downloaded on 15 October 2004.
RIVERO, J. & M.A. SERNA (1988): La identificacion de los Colostethus (Amphibia, Dendrobatidae)
XXde Colombia. - Caribbean Journal of Science, Vol. 24, No. 3-4: pp.137-154
SAPORITO, R.A., GARRAFFO, H.M., DONNELLY, M.A. , EDWARDS, A.L., LONGINO, J.T., & J.W. DALY (2004):
XXFormicine ants: An arthropod source for the pumiliotoxin alkaloids of dendrobatid poison frogs.
XX- Proc.Nat.Acad.Sci USA 101 (21):8045-8050
VENCES, M. , KOSUCH, J. , BOISTEL, R. , HADDAD, C.F.B. , LA, MARCA, E. , LÖTTERS, S. & M. VEITH (2003): Convergent evolution of aposematic coloration in Neotropical poison frogs: a molecular
XXphylogenetic perspective. - Org. Divers. Evol. 3: 215 - 226. (PDF)
WELLS, K.D. (1980): Behavioral Ecology an Social Organization of a Dendrobatid Frog
XX(Colostethus inguinalis). - Behav. Ecol. Sociobiol. 6, 199-209
| Zitierung: | Einklappen |
OSTROWSKI, T. & T. MAHN (2024): Artbeschreibung Colostethus panamensis.
- Dendrobase.de - Eine Online-Datenbank der Familie Dendrobatidae (Anura).
https://www.dendrobase.de/html/D_colostethus_panamensis.html; Stand: Februar 2024
- Dendrobase.de - Eine Online-Datenbank der Familie Dendrobatidae (Anura).
https://www.dendrobase.de/html/D_colostethus_panamensis.html; Stand: Februar 2024
| Link für Website Betreiber: | Einklappen |
Webmaster dürfen Links von Ihren Seiten zur DendroBase erstellen, wenn sie folgende Kriterien erfüllen:
- Die Website enthält weder illegale, rassistische oder sexistische Inhalte
- Das Thema der Website bezieht sich auf Frösche
- Der Link genau wie folgend angegeben verwendet wird:
<a href="https://www.dendrobase.de/html/D_colostethus_panamensis.html" target="_new">Colostethus panamensis (DendroBase.de)</a>
- Die Website enthält weder illegale, rassistische oder sexistische Inhalte
- Das Thema der Website bezieht sich auf Frösche
- Der Link genau wie folgend angegeben verwendet wird:
<a href="https://www.dendrobase.de/html/D_colostethus_panamensis.html" target="_new">Colostethus panamensis (DendroBase.de)</a>
| Fotos | Einklappen |
DendroBase.de Version 5 | Impressum | Datenschutzerklärung













