| Login | Einklappen |
Startseite
Artbeschreibungen
Allobates
Anomaloglossus
Rheobates
Aromobates
Mannophryne
Ameerega
Colostethus
Epipedobates
Silverstoneia
Andinobates
Adelphobates
Dendrobates
Excidobates
Minyobates
Oophaga
Phyllobates
Ranitomeya
Hyloxalus
Foren
Inserate
Reportagen
Service & Links
Einstellungen
| Fotos von Nutzern | Einklappen |
| Nomenklatur | Einklappen |
wissenschaftl. Name: Oophaga speciosa (O. SCHMIDT, 1857)
Etymologie:
Synonyme:
Oophaga speciosa (GRANT, FROST, CALDWELL, GAGLIARDO, HADDAD, KOK, MEANS, NOONAN, SCHARGEL & WHEELER, 2006)
Dendrobates speciosus (SAVAGE, 1968)
Hylaplesia speciosa (GÜNTHER, 1859)
Dendrobates speciosus (O. SCHMIDT, 1857)
englischer Name: Splendid Poison Frog
deutscher Name: Glanzbaumsteiger
niederländischer Name: glanzende gifkikker
Etymologie:
Das speciosa* ist lateinisches Adjektiv für "wohlgestaltet". Es nimmt Bezug auf die ansprechende Färbung und glänzende Haut der Art.
*Aufgrund des weiblichen Wortstammes der Gattung ergeben sich in neuer Kombination mit Oophaga (f) auch bei den Artnamen einige Änderungen hinsichtlich der geschlechtsbestimmenden Suffixe (Wortendungen) von –us (m) nach –a (f). Aus Dendroates speciosus (m) wird das Taxon Oophaga speciosa (f)
*Aufgrund des weiblichen Wortstammes der Gattung ergeben sich in neuer Kombination mit Oophaga (f) auch bei den Artnamen einige Änderungen hinsichtlich der geschlechtsbestimmenden Suffixe (Wortendungen) von –us (m) nach –a (f). Aus Dendroates speciosus (m) wird das Taxon Oophaga speciosa (f)
Synonyme:
Oophaga speciosa (GRANT, FROST, CALDWELL, GAGLIARDO, HADDAD, KOK, MEANS, NOONAN, SCHARGEL & WHEELER, 2006)
Dendrobates speciosus (SAVAGE, 1968)
Hylaplesia speciosa (GÜNTHER, 1859)
Dendrobates speciosus (O. SCHMIDT, 1857)
englischer Name: Splendid Poison Frog
deutscher Name: Glanzbaumsteiger
niederländischer Name: glanzende gifkikker
| Systematik | Einklappen |
Klassifizierung:
Amphibia->Anura->Dendrobatoidea->Dendrobatidae->Dendrobatinae->Oophaga->Oophaga speciosa (O. SCHMIDT, 1857)
Gruppe:
Anmerkung zur Systematik:
Amphibia->Anura->Dendrobatoidea->Dendrobatidae->Dendrobatinae->Oophaga->Oophaga speciosa (O. SCHMIDT, 1857)
Gruppe:
Die Gattung Oophaga BAUER 1994 entspricht der ehemaligen Histrionicus-Gruppe im Sinne von MYERS (1984) bzw der Einteilung von SILVERSTONE (1975) in Pumilio- und Histrionicus-Gruppe.
Anmerkung zur Systematik:
Aufgrund der Konstantheit hinsichtlich der genetischen Charakteristika (monophyletisch abgrenzbare Gruppe), der gemeinsamen Verhaltensparameter (z.B. Zirp-Ruf, weibliche Brutpflege) und morphologischen Besonderheiten (z.B. Larvenmorphologie) wurden die Arten der ehemaligen Dendrobates histrionicus-Gruppe (sensu MEYER & DALY, 1984) von GRANT ET AL. (2006) in eine eigenständige Gattung überstellt. Für diese wurde der verfügbare ältere Name Oophaga BAUER, 1994 wieder gültig (bisher Synonym zu Dendrobates WAGLER, 1830).
| Bedrohungsstatus | Einklappen |
Anhang II des WA. Anhang B der EU-ArtSchVO. Meldepflichtig nach BArtSchVO.
Nach IUCN (2004): Bedroht. Populationen abnehmend. Nicht akut gefährdet, aber generell aufgrund des kleinen Verbreitungsgebietes in Gefahr. Als Höhenart ist eine erhöhte Gefährdung durch Chytridiomykosen (Batrachochytridium dendrobatidis) gegeben. Populationen von Atelopus varius haben im gleichen Verbreitungsgebiet schon stark abgenommen (BERGER ET AL., 1998).
Nach IUCN (2004): Bedroht. Populationen abnehmend. Nicht akut gefährdet, aber generell aufgrund des kleinen Verbreitungsgebietes in Gefahr. Als Höhenart ist eine erhöhte Gefährdung durch Chytridiomykosen (Batrachochytridium dendrobatidis) gegeben. Populationen von Atelopus varius haben im gleichen Verbreitungsgebiet schon stark abgenommen (BERGER ET AL., 1998).
| Beschreibung | Einklappen |
| Größe Mittelgroße Pfeilgiftfrosch-Art mit einer von 26-30 mm. Von JUNGFER (1985) gefangene Tiere hatten eine Größe von 28-29 mm. |
Nach JUNGFER (1985) Haut glatt (Jungtiere leicht granuliert), hell- bis dunkel weinrot. Dorsal meist mit schwarzen Flecken bzw. Sprenkeln, unregelmäßig in Größe, Form und Verteilung. Haftscheiben der Finger und Zehen manchmal weiß.
Achtung! In der Literatur wird manchmal die teilweise ähnlich gefärbte Bribri-Variante von O. pumilio fälschlicherweise als O. speciosa abgebildet.
Achtung! In der Literatur wird manchmal die teilweise ähnlich gefärbte Bribri-Variante von O. pumilio fälschlicherweise als O. speciosa abgebildet.
Variation:
Keine Angaben.
Alter:
Keine Angaben.
Geschlechtsreife:
Keine Angaben.
Hautgifte:
EDWARDS ET AL. (1988) konnten 30 verschiedene Alkaloide nachweisen. Als Hauptbestandteile wurden Pumiliotoxin 251D, Pumiliotoxin A [307A], Pumiliotoxin B [323A], und Allopumiliotoxin 267A identifiziert. Für Details siehe die angeführte Arbeit.
| Gelege und Larven | Einklappen |
Merkmale Gelege:
Merkmale Larven:
Entwicklungszeiten:
Ernährung:
Legt nach JUNGFER (1985) bis zu 16 (im Schnitt 8) Eier auf glatte Blätter.
Merkmale Larven:
JUNGFER (1985) beschreibt eine Larve im Stadium 32 (nach GOSNER, 1966): Farbe dunkelbraun (Schwanz hellbraun) mit schwacher dunkelroter Fleckung (in diesem Stadium), GL: 20,5 mm, KRL: 8,5 mm. Körper breiter als hoch, links und eher ventral, dorsaler Flossensaum reicht nicht bis zum Körper, Schwanzspitze gerundet und leicht nach oben gekrümmt, Mundfeld mit Lippenzähnen unten (0/1)und am unteren Rand mit bis zu 16 großen .
 Abb.: Mundfelde der Larve von O. speciosa, Stadium 32 (GOSNER). © 2005 () nach JUNGFER (1985). Mundfeld vergleichen: |
Die Larven schlüpfen nach BEUTELSCHIESS (1983) nach 13-17 Tagen (22-26 °C). Unter natürlichen Bedingungen benötigen die Larven 78-84 Tage bis zur vollständigen Metamorphose (JUNGFER, 1985).
Ernährung:
Die Larven fressen nur die vom Weibchen produzierten speziellen Nähreier. Als Ersatzfutter wird Eigelb angenommen. BEUTELSCHIESS (1983) beschreibt neben der bekannten Eigelbmethode von BECHTER (1978) eine Aufzucht mit Kunstfutter bestehend aus Margerquark, Eigelb, Sojaflocken und Osspulvit (Vitamin-Mineralstoffgemisch), die Ontogenese (Entwicklung) bei Fütterung mit Eigelb und Quarkgemisch war allerdings deutlich verlängert und dauerte bis zu 162 Tage statt ca. 80 Tage bei natürlicher Aufzucht (JUNGFER, 1985). Außerdem traten bei künstlich aufgezogenen Quappen Streichholzbeine auf (Phänomen ebenfalls von O. histrionica und O. pumilio bekannt).
| Verhalten (Ethologie) | Einklappen |
Allgemeines Verhalten:
Revierverhalten:
Balzverhalten:
Brutpflegeverhalten:
Lautäußerung (Vokalisation):
Nach JUNGFER (1985) ein tagaktiver wenig scheuer Frosch. Hauptsächlich vormittags und am Nachmittag aktiv. Nachts auf Ruheplätzen (meist Blätter).
Revierverhalten:
Wie die meisten Arten der Gattung Oophaga mit ausgeprägtem Revierverhalten. JUNGFER (1985) berichtet von Angriffen eines dominanten Männchen auf ein ebenfalls rufendes Männchen. Dabei kam es zu Anspringen von hinten und Klammern. Auch nicht paarungsbereite Weibchen werden angesprungen wenn sie nicht auf den Ruf reagieren. Dieses Verhalten konnte der Autor auch bei O. pumilio beobachten (OSTROWSKI, pers. Beobachtung). Aggressives Verhalten zwischen Weibchen wurden von JUNGFER nicht beobachtet.
Balzverhalten:
Das Balzverhalten ähnelt sehr stark dem von O. pumilio. Für genauere Angaben siehe dort oder bei JUNGFER, 1985.
Brutpflegeverhalten:
Das Brutpflegeverhalten gleicht stark dem von O. pumilio. Im Gegensatz zu O. pumilio bewässert das Männchen von O. speciosa das Gelege nur in den ersten Tagen , danach übernimmt hauptsächlich das Weibchen diese Aufgabe (JUNGFER, 1985). Damit steht O. speciosa in diesem Verhalten genau zwischen O. pumilio, mit ausschließlich väterlicher Gelegebewässerung und O. histrionica, mit ausschließlich mütterlicher Gelegebetreuung. Nach dem Schlupf werden die Larven vom Weibchen aufgenommen. Dabei nimmt es die so genannte Schüssselrückenstellung ein (nach JUNGFER, 1985). Das Weibchen setzt sich in das Gelege und beugt den Rücken nach unten durch (schüsselförmig). Die Larven schlängeln sich daraufhin auf den Rücken der Mutter. Die Larven werden dann meist einzeln in ta abgesetzt. Das Weibchen besucht die Achseln in unregelmäßigen Abständen alle 3-6 Tage. Es starrt dabei längere Zeit in die Bromelienachseln. Ist eine Quappe vorhanden, antwortet diese mit vibrierenden Bewegungen des Schwanzes. Das Weibchen kriecht daraufhin in die Phytotelma und verharrt dort, teilweise komplett untergetaucht, etwa 5 min. Dabei legt es 4-10 unbefruchtete Nähreier spezieller Zusammensetzung. Larven durchbeißen die Gallerte und fressen die Eier. Weibchen versorgen so etwa 1-4 Larven gleichzeitig. Weibchen von O. speciosa verhalten sich somit identisch bei der Larvenversorgung wie von WEYGOLD (1978) für O. pumilio beschrieben wurde. JUNGFER berichtet von Brutverschränkung. Während der etwa 14 tägigen Entwicklungsdauer, des ersten abgesetzten Geleges, laichen Weibchen durchaus weitere Male mit einem oder mehreren Männchen ab. Sie bewässern dann gleichzeitig bis zu 3 Gelege unterschiedlicher Entwicklungsstadien gleichzeitig. Diese Brutverschränkung, eine gleichzeitige Betreuung mehrerer Bruten, dient als Vorsorge im Falle eines Gelegeverlustes. Sind aber erst einmal Larven eines Geleges in Phytotelmata deponiert und werden gefüttert, werden die übrigen Gelege nicht mehr weiter betreut und weitere Paarungen nicht mehr beobachtet. Während der gesamten Fütterungsphase der Jungtiere (ca. 80 Tage) werden keine befruchteten Gelege mehr abgesetzt. Erst nach dem Verlassen der Jungtiere aus ihren Phytotelmata werden erneut Gelege abgesetzt.
Lautäußerung (Vokalisation):
Männchen rufen den ganzen Tag aber besonders verstärkt in den Vormittagsstunden. Es handelt sich um einen lauten, harten, insektenähnlichen (chirp-call). JUNGFER (1985) beschreibt zwei Ruftypen. Ruftyp 1: (advertisement-call) und Ruftyp 2: (close-range-mating-call). Der Anzeigeruf (auch Werberuf genannt) besteht aus mit gepulsten : Notenlänge: 70-90 ms, : 80-110 ms, : 5,9/s, Frequenzbereich: 3130-3660 Hz. Über Dominanzfrequenz, Pulslänge und Interpulsintervall macht JUNGFER keine Angaben. Dieser Ruf dient der Abwehr von Reviereindringlingen und der Anlockung von paarungswilligen Weibchen. Der Nahbereichs-Werberuf (Ruftyp 2) ist deutlich leiser und besteht ebenfalls aus gepulsten Einzelnoten aber von anderer Dauer und Frequenz: 79-80 ms bei 2400-3200 Hz. Die Internotenintervalle sind deutlich länger. Dadurch erscheint der Ruf langsamer in der Rufrate. Dieser Ruftyp dient der Einleitung zur Paarung. Solche verlangsamten Werberufe scheinen typisch für die Gattung Oophaga zu sein (OSTROWSKI, pers. Beobachtungen)
| Lebensraum | Einklappen |
Typenfundort der Erstbeschreibung
Daten von OpenStreetMap - Veröffentlicht unter CC-BY-SA 2.0
Biotop: lebt in unberührten en Bergregen- und Nebelwäldern in Höhen von 1100 bis 1400m. Die Frösche sind im natürlichen Habitat sehr selten und wurden nur an natürlichen oder geformten Lichtungen bzw. Kahlschlägen vermehrt gefunden (JUNGFER, 1985). Die Ansammlung an solchen Licht-Inseln lässt sich vielleicht mit erhöhter Futterdichte (JUNGFER, 1985) oder mit einer Konzentration der lichtbedürftigen Brutpflanzen (Heliconia sp., Dieffenbachia sp., Bromeliaceae) erklären. Nach PRÖHL (2002) lassen sich beim nah verwandten O. pumilio in Sekundärbiotopen deutlich höhere Populationsdichten nachweisen, da oft mehr Brutpflanzen und Strukturen zur Verfügung stehen. JUNGFER (1985) fand Tiere entlang eines 10 x 150 m langen gerodeten Streifens zwischen Straße und Wald. Die Populationsdichte war mit mehr als 200 Tieren hoch. Die Tiere lebten zwischen den Stämmen in den verrottenden Pflanzenmaterialien. Ähnliche Beobachtungen konnte der Autor in Costa Rica in einem Biotop von O. cf. typographa machen (OSTROWSKI, pers. Beobachtung). JUNGFER (1985) fand die Tiere nur im Schatten bei Bodentemperaturen von 20,5 °C. Im Gebiet leben Oophaga arborea, Silverstoneia nubicola, Colostethus pratti und Atelopus varius mit O. speciosa .

Abb.: Regenwald der prämontanen Stufe im Gebiet des Lago Fortuna. Lebensraum von O. speciosa. © 2005 Thomas Ostrowski

Abb.: Berghänge der Cordillären in 800m Höhe
© 2006 Thomas Ostrowski
Klima:
"das Grenzgebiet zwischen Neu-Granada[Kolumbien mit Provinz Panama] und Costa Rica,der Weg zwischen Bocca del toro und dem Vulcan Chiriqui [Panama]...zwischen 5000´ und 7000´ Höhe" [polnische Fuß entsprechen = 1150-1160 m]. (SCHMIDT, 1858)
Verbreitung: | 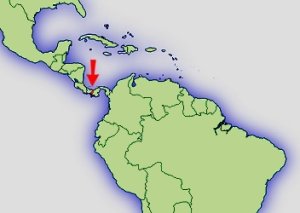 Abb.: Verbreitungsgebiet Oophaga speciosa © 2008 () |
Biotop:

Abb.: Regenwald der prämontanen Stufe im Gebiet des Lago Fortuna. Lebensraum von O. speciosa. © 2005 Thomas Ostrowski

Abb.: Berghänge der Cordillären in 800m Höhe
© 2006 Thomas Ostrowski
Klima:
Die Klimastufe des en Bergregenwaldes am Übergang zum Nebelwald wird als bezeichnet. Es herrscht gemäßigtes, tropisches Klima mit ausgeprägtem Tageszeitenklima (Temperaturschwankungen der Monatsmittel gering, im Tagesverlauf hoch) und karibischen Starkregen ohne ausgeprägte Trockenzeit. An dieser Stelle Westpanamas ist nicht die Wasserscheide der höchste Punkt der Cordillera de Talamancae und der Serranía de Tabasará, sondern die höheren Berge liegen vollständig auf der Pazifikseite. Dadurch fangen sie die unter Nordost Passat stehende Winde der karibischen Seite erst auf der Pazifikseite ab und es regnet hier deutlich mehr und regelmäßiger, als dies sonst auf der Pazifikseite üblich wäre (vgl. Diagramme). Die mittlere Jahresdurchschnittstemperatur liegt auf 1200 m Höhe bei 18,9 °C. Die höchste gemessene Temperatur liegt bei 23° C von Mai bis September. Die tiefsten Tagesmittel bei 15,5 °C im Dezember und Februar. - Alle Temperaturangaben IRHE, Instituto Recursos Hidráulicos y Electrificación, Projecto Fortuna, aus JUNGFER (1985, 1988). Dennoch können nach starken Regen, windigen Nächten oder bei starker Sonneneinstrahlung auch deutlich höhere Temperaturschwankungen auftreten. Nachts können die Temperaturen bis auf 10 °C fallen und am Tag bei intensiver Sonneneinstrahlung auch bis auf 26 °C steigen. (OSTROWSKI, eigene Messungen). Die Wolken hängen tief und fangen sich als Nebel oder Regengüsse an den Hängen der Cordillera. Das Wetter ist wechselhaft und kann innerhalb kürzester Zeit von Sonnenschein über Nebelschwaden zu starken Regengüssen wechseln.
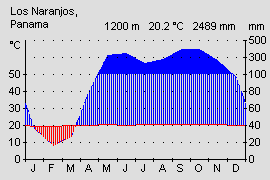 Abb.: Klimadiagramm der Pazifikseite mit typischer Trockenperiode | 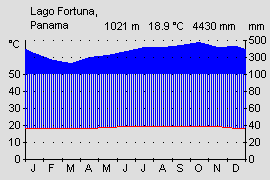 Abb.: Klimadiagramm der Pazifikseite unter karibischem Einfluss. |
| Haltung im Terrarium | Einklappen |
Terrarium/Einrichtung:
Temperaturen:
Luftfeuchte:
Ernährung:
Besatz:
Tipps zur Zucht:
Varianten in Terrarienhaltung:
ab 40x40x60cm. Bodenbewohner klettert aber auch. Dichte Bepflanzung mit Ranken und mit Bromelien als Brutpflanzen.
Temperaturen:
Tags 20-24 °C. Starke Temperaturschwankungen simulieren und Temperatur nachts möglichst um 5 ° senken. Keine Trockenperiode nötig.
Luftfeuchte:
Nachts bei 100% (Nebel), Tagsüber 75-85%, gegen Mittag leicht abfallen lassen
automatische Beregnung und Nebelanlage (!!!) empfehlenswert. Staunässe vermeiden
automatische Beregnung und Nebelanlage (!!!) empfehlenswert. Staunässe vermeiden
Ernährung:
Übliche kleine Futtertiere wie , Mikro-Heimchen, , Wiesenplankton. BEUTELSCHIESS (1983) berichtet von einer Vorliebe für Milben.
Besatz:
am günstigsten 1,1
Tipps zur Zucht:
Die Zucht verläuft ähnlich wie bei O. pumilio. Die Art wurde bisher selten gehalten und vermehrt. BEUTELSCHIESS (1983) berichtet von einer erfolgreichen Zucht, wobei die Weibchen keine Nähreier produzierten und die Larven mit Ersatzfutter aufgezogen wurden (Magerquark, Eigelb, Sojapulver und Osspulvit). JUNGFER (1985) konnte die Art unter natürlichen Bedingungen aufziehen. Die Larven sind kannibalisch und müssen bei künstlicher Aufzucht getrennt gehältert werden. Jungfrösche wurden von beiden Autoren ohne größere Probleme mit Springschwänzen und Milben aufgezogen. Die künstliche Aufzucht (mit Eigelb oder Ersatzeiern fremder Arten) ist mühsam und oft mit Entwicklungsstörungen behaftet. Eine natürliche Brutpflege sollte deshalb das Ziel des engagierten Terrarianers sein!
Varianten in Terrarienhaltung:
| Holotyp |  |
Daten errechnet aus von Nutzern gemeldeten Fröschen (Home->Meine Frösche) und den aktuellen Inseraten.
stand 23.07.2025 19:45 Uhr
stand 23.07.2025 19:45 Uhr
| Autoren dieser Seite: | Einklappen |
| Referenzen | Einklappen |
BECHTER, R. (1978): Das Ei des Kolumbus. Zur Aufzucht von Dendrobates pumilio und lehmanni.
XX - Aquarien Magazin 12(6): 272-276
BERGER, L., SPEARE, R., DASZAK, P., GREEN, D.E., CUNNINGHAM, A.A., GOGGIN, C.L., SLOCOMBE, R., RAGAN, M.A., HYATT, A.D., MCDONALD, K.D., HINES, H.B., LIPS, K.R., MARANTELLI, G.,
& H. PARKES (1998): Chytridiomycosis causes amphibian mortality associated with population
XXdeclines in the rainforests of Australia and Central America.
XX-Proc. Natl. Acad. Sci. USA. 95: 9031–9036
BEUTELSCHIESS, J. & C. BEUTELSCHIESS (1983): Dendrobates speciosus. - ein Rubin im Terrarium.
XX- herpetofauna, Weinstedt, 5 (25): 6-8
CITES (2005): Convention on International Trade of Endangered Species of Wild Fauna and Flora.
XXOnlineversion: 11.08.05. Electronic Database accessible at http://www.cites.org/index.html
EDWARDS, M.W., DALY , J.W. & C.W. MYERS (1988): Alkaloids from a panamanian poison frog,
XXDendrobates speciosus: identification of pumiliotoxin-A and allopumiliotoxin class alkaloids,
XX3,5-disubstituted indolizidines, 5-substituted 8-methylindolizidines, and a 2-methyl-6-nonyl-
XX4-hydroxypiperidine. - J Nat Prod., 51 (6): 1188-97.
FROST, D.R. (2007): Amphibian Species of the World: an Online Reference. Version 5.0 (1.02.2007).
XXElectronic Database accessible at http://research.amnh.org/herpetology/amphibia/index.php
XX Am.Mus.Nat.Hist. New York, USA.
GOSNER, K.L. (1960): A Simplified Table for Staging Anuran Embryos and Larvae.
XX-Herpetologica, 16: 183-190
GRANT, T . , FROST, D. R. , CALDWELL, J. P. , GAGLIARDO, R. , HADDAD, C. F. B. , KOK, P. J. R. ,
XXMEANS, D.B. , NOONAN, B. P. , SCHARGEL, W. E. & W.C. WHEELER (2006): Phylogenetic
XXsystematics of dart-poison frogs and their relatives (Amphibia, Athesphatanura, Dendrobatidae).
XX - Bulletin of the Am.Mus.Nat.Hist. 299. (PDF)
IUCN, Conservation International, and NatureServe. (2009): Global Amphibian Assessment.
XXwww.globalamphibians.org. Downloaded on 15 October 2004.
JUNGFER, K.H. (1985): Beitrag zur Kenntnis von Dendrobates speciosus O. SCHMIDT, 1857.
XX- Salamandra, Bonn, 21 (4): 263-280.
JUNGFER, K.H. (1988): Froschlurche von Fortuna, Panama. II. Hylidae (2), Centrolenidae,
XXDendrobatidae.- herpetofauna, Weinstadt, 19 (56): 6-12.
PRÖHL, H. (2002): Population differences in female resource abundance, adult sex ratio, and male
XXmating success in Dendrobates pumilio. - Behav Ecol 13(2): 175-181.
WEYGOLD, P. (1980): Complex Broodcare and reproductive behavior in captive poison-arrow frogs,
XXDendrobates pumilio O. Schmidt. - Behav Ecol Sociobiol 7: 329-332
XX - Aquarien Magazin 12(6): 272-276
BERGER, L., SPEARE, R., DASZAK, P., GREEN, D.E., CUNNINGHAM, A.A., GOGGIN, C.L., SLOCOMBE, R., RAGAN, M.A., HYATT, A.D., MCDONALD, K.D., HINES, H.B., LIPS, K.R., MARANTELLI, G.,
& H. PARKES (1998): Chytridiomycosis causes amphibian mortality associated with population
XXdeclines in the rainforests of Australia and Central America.
XX-Proc. Natl. Acad. Sci. USA. 95: 9031–9036
BEUTELSCHIESS, J. & C. BEUTELSCHIESS (1983): Dendrobates speciosus. - ein Rubin im Terrarium.
XX- herpetofauna, Weinstedt, 5 (25): 6-8
CITES (2005): Convention on International Trade of Endangered Species of Wild Fauna and Flora.
XXOnlineversion: 11.08.05. Electronic Database accessible at http://www.cites.org/index.html
EDWARDS, M.W., DALY , J.W. & C.W. MYERS (1988): Alkaloids from a panamanian poison frog,
XXDendrobates speciosus: identification of pumiliotoxin-A and allopumiliotoxin class alkaloids,
XX3,5-disubstituted indolizidines, 5-substituted 8-methylindolizidines, and a 2-methyl-6-nonyl-
XX4-hydroxypiperidine. - J Nat Prod., 51 (6): 1188-97.
FROST, D.R. (2007): Amphibian Species of the World: an Online Reference. Version 5.0 (1.02.2007).
XXElectronic Database accessible at http://research.amnh.org/herpetology/amphibia/index.php
XX Am.Mus.Nat.Hist. New York, USA.
GOSNER, K.L. (1960): A Simplified Table for Staging Anuran Embryos and Larvae.
XX-Herpetologica, 16: 183-190
GRANT, T . , FROST, D. R. , CALDWELL, J. P. , GAGLIARDO, R. , HADDAD, C. F. B. , KOK, P. J. R. ,
XXMEANS, D.B. , NOONAN, B. P. , SCHARGEL, W. E. & W.C. WHEELER (2006): Phylogenetic
XXsystematics of dart-poison frogs and their relatives (Amphibia, Athesphatanura, Dendrobatidae).
XX - Bulletin of the Am.Mus.Nat.Hist. 299. (PDF)
IUCN, Conservation International, and NatureServe. (2009): Global Amphibian Assessment.
XXwww.globalamphibians.org. Downloaded on 15 October 2004.
JUNGFER, K.H. (1985): Beitrag zur Kenntnis von Dendrobates speciosus O. SCHMIDT, 1857.
XX- Salamandra, Bonn, 21 (4): 263-280.
JUNGFER, K.H. (1988): Froschlurche von Fortuna, Panama. II. Hylidae (2), Centrolenidae,
XXDendrobatidae.- herpetofauna, Weinstadt, 19 (56): 6-12.
PRÖHL, H. (2002): Population differences in female resource abundance, adult sex ratio, and male
XXmating success in Dendrobates pumilio. - Behav Ecol 13(2): 175-181.
WEYGOLD, P. (1980): Complex Broodcare and reproductive behavior in captive poison-arrow frogs,
XXDendrobates pumilio O. Schmidt. - Behav Ecol Sociobiol 7: 329-332
| Zitierung: | Einklappen |
OSTROWSKI, T. & T. MAHN (2025): Artbeschreibung Oophaga speciosa.
- Dendrobase.de - Eine Online-Datenbank der Familie Dendrobatidae (Anura).
https://www.dendrobase.de/html/D_oophaga_speciosa.html; Stand: Juli 2025
- Dendrobase.de - Eine Online-Datenbank der Familie Dendrobatidae (Anura).
https://www.dendrobase.de/html/D_oophaga_speciosa.html; Stand: Juli 2025
| Link für Website Betreiber: | Einklappen |
Webmaster dürfen Links von Ihren Seiten zur DendroBase erstellen, wenn sie folgende Kriterien erfüllen:
- Die Website enthält weder illegale, rassistische oder sexistische Inhalte
- Das Thema der Website bezieht sich auf Frösche
- Der Link genau wie folgend angegeben verwendet wird:
<a href="https://www.dendrobase.de/html/D_oophaga_speciosa.html" target="_new">Oophaga speciosa (DendroBase.de)</a>
- Die Website enthält weder illegale, rassistische oder sexistische Inhalte
- Das Thema der Website bezieht sich auf Frösche
- Der Link genau wie folgend angegeben verwendet wird:
<a href="https://www.dendrobase.de/html/D_oophaga_speciosa.html" target="_new">Oophaga speciosa (DendroBase.de)</a>
| Fotos | Einklappen |
DendroBase.de Version 5 | Impressum | Datenschutzerklärung


