| Login | Einklappen |
| Fotos von Nutzern | Einklappen |
| Nomenklatur | Einklappen |
Etymologie:
Synonyme:
Oophaga pumilio (GRANT, FROST, CALDWELL, GAGLIARDO, HADDAD, KOK, MEANS, NOONAN, SCHARGEL & WHEELER, 2006)
Oophaga pumilio (BAUER, 1994)
Dendrobates galindoi (TRAPIDO, 1953)
Dendrobates typographicus (OERTTER, 1951)
Hylaplesia typographa (BROCCHI, 1882)
Dendrobates ignitus (COPE, 1874)
Dendrobates typographus (KEFERSTEIN, 1867)
Hylaplesia pumilio (GÜNTHER, 1859)
Dendrobates pumilio (O. SCHMIDT, 1857)
englischer Name: Red-and-blue Poison Frog (CITES), Flaming Poison Frog (CITES)
deutscher Name: Panama-Zwergbaumsteiger
spanischer Name: Rana roja, Rana venenosa
niederländischer Name: Aardbeikikkertje
| Systematik | Einklappen |
Amphibia->Anura->Dendrobatoidea->Dendrobatidae->Dendrobatinae->Oophaga->Oophaga pumilio (SCHMIDT, 1857)
Gruppe:
Anmerkung zur Systematik:

Abb.: Maximum Likelihood Phylogenie der Pumilio-Klade, basierend auf 16 SrRNA, Cyt b und COI Sequenzen. (CR = Costa Rica-Population, P = Panama-Population, S = südliche Klade, N = nördliche Klade, E = Isla Escudo). HAGEMANN & PRÖHL (submitted), © 2007 Sabine Hagemann
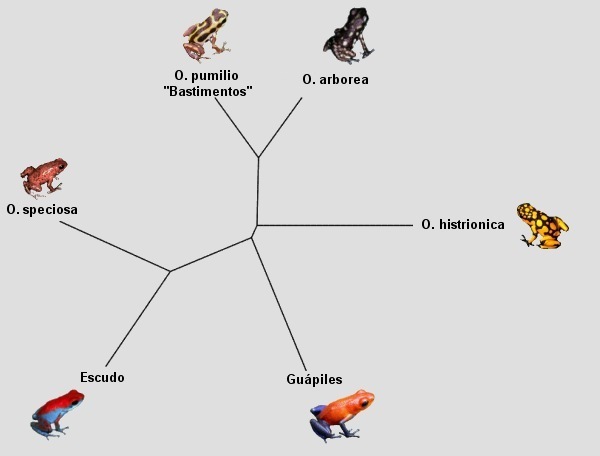
Abb: Neighbour-joining tree (Cytochrom b, Cytochrom Oxidase I und 16SrRNA). HAGEMANN, 2005.
© Sabine Hagemann & Thorsten Mahn 2006.
| Bedrohungsstatus | Einklappen |
Anhang II des WA. Anhang B der EG-VO 338/97. Melde- und Nachweispflicht nach § 6 Abs. 2 BArtSchVO.
| Beschreibung | Einklappen |
| Größe Mittelgroße Oophaga-Art mit einer Kopf-Rumpf-Länge von 14 - 22 mm und einem Gewicht von 155 - 970 mg (je nach Population). Eine Untersuchung der Körperlänge () und des Gewichtes () von 165 Individuen aus 11 verschiedenen Populationen des Bocas-Archipels ergab eine mittlere Größe von 18,2 mm (+/- 1,68 mm) und ein mittleres Gewicht von 556 mg (+/- 165 mg). Dabei gibt es erhebliche Gewichts- und Größenunterschiede zwischen den verschiedenen Populationen (s. Tab.). Bei O. pumilio liegt also nicht nur ein in Bezug auf die Färbung sondern auch auf die Körpermaße vor. Daten nach HAGEMANN (2005). Tab.: Kopf-Rumpf-L�nge und Gewicht (Mittelwerte und Standardabweichung) verschiedener Populationen von O. pumilio. Daten nach HAGEMANN (2005)
|  © 2008 Thorsten Mahn |
Ein deutlicher ist nicht vorhanden. Rufende Männchen zeigen unmittelbar nach dem Rufen einen dunkel gefärbten Bereich um die subgulare Schallblase. Dieser ist je nach Variante und Individuum mehr oder weniger deutlich ausgeprägt. Bei Männchen, die längere Zeit nicht gerufen haben (unterdrückte Tiere, Tiere ohne Revier) ist diese dunkle Markierung aber oft undeutlich oder gar nicht zu sehen und deshalb kein sicheres Unterscheidungsmerkmal. Je nach Alter und Ernährungszustand besitzen Weibchen meist eine etwas größere Kopf-Rumpf-Länge und einen etwas fülligeren Körper (OSTROWSKI, pers. Beobachtung)
 Abb.: ()Dorsal- und Ventralansicht von Oophaga pumilio © 2008 () | Größe vergleichen: Dorsal- und Ventralbild vergleichen: |
Variation:

Abb.: Variabilität von O. pumilio "Róbalo" innerhalb einer Subpopulation am Fundort: Quebrada Cascaje.
(A) + (F) häufig vorkommende Zeichnungsmuster (A: Róbalo-Muster mit schwarzen Beinen, F: Uyama-Muster mit braunen Beinen). (B) - (E) an diesem Fundot selten vorkommende Zeichnungsmuster. (G) Ventrale von Tier B. (H) Ventrale von Tier A. © Thomas Ostrowski
Tab.: Namen, Größenangaben und Farbmusterverteilung verschiedener Populationen von Oophaga pumilio
Geschlechtsreife:
Hautgifte:
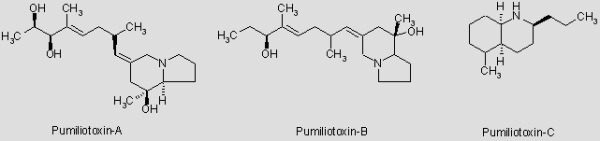
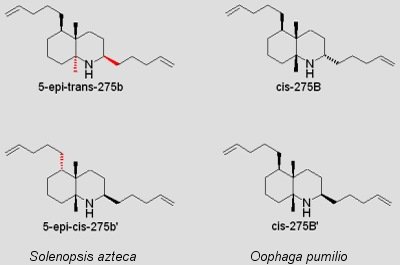
Die Herkunft der Gifte war lange Zeit nicht bekannt. Sie werden aber wohl nicht vom Frosch selbst produziert, sondern hauptsächlich durch die Nahrung aufgenommen, angereichert und evtl. leicht modifiziert. So konnten SPANDE ET AL (1999) erstmals zwei Toxine der Decahydrochinolin-Klasse im Körper der tropischen Ameise Solenopsis azteca nachweisen. Decahydochinoline sind eine der Hauptgiftklassen bei Pfeilgiftfröschen und diese Ameisenart wird auch von Pfeilgiftfröschen erbeutet. So fanden die Forscher um SPANDE dann auch zwei Stereoisomere (geringfügig abgewandelte Form) der Ameisentoxine in der Haut von O. pumilio. Diese Befunde sprechen für die Vermutung, dass die Nahrung der Frösche der Ursprung der Toxine ist.
 |
 |
| Gelege und Larven | Einklappen |
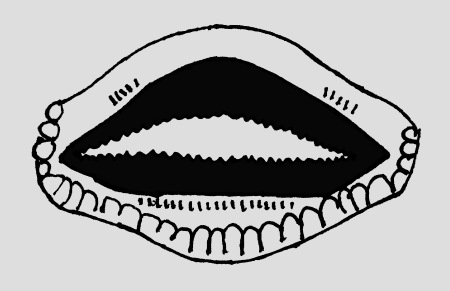 Abb.: ()Mundfeld von O. pumilio. Nach SAVAGE (2002). © 2005 T. Ostrowski Mundfeld vergleichen: |  Abb.: ()Larve Oophaga pumilio Statium 44 © 2008 () |
Entwicklungszeiten:
Ernährung:
| Verhalten (Ethologie) | Einklappen |
Revierverhalten:

Abb.: Männchen beim Ringkampf
© 2005 I. Meuche

Abb.: Weibchen frisst fremdes Gelege.
© 2005 Thomas Schäffer
Erstaunlich ist auch die Orientierungsfähigkeit beim Wiederauffinden des eigenen Reviers. Nach einer Entnahme aus dem angestammten Revier und einer ortsfremden Freisetzung finden die meisten O. pumilio ihr eigenes Revier, auch über viele Meter entfernt, zielgerichtet wieder. Dabei werden oft unbekannte Gebiete außerhalb des eigenen es und mehrere fremde Reviere anderer O. pumilio durchquert (OSTROWSKI, pers. Beobacht.). Eine erstaunliche Leistung für einen Frosch von nur ca. 2 cm Länge. Eine allein optische Orientierung an Geländemarken kann, bei einem so kleinen Frosch und einem stark strukturiertem, unübersichtlichem Biotop, nur eine untergeordnete Rolle spielen. Sie kann nur innerhalb des bekannten (relativ kleinen) Aktionsraumes von Bedeutung sein. Versuche von FORESTER & WISNIESKI (1991) deuten daraufhin, dass für das Wiedererkennen des eigenen Territoriums der Geruchsinn eine wichtige Rolle spielt. Im Experiment bevorzugten die Frösche von zwei angebotenen Gerüchen den Geruch ihres angestammten Reviers, dem bewohnten Terrarium. Vor allem flüchtige chemische Substanzen, die von den Pflanzen (z.B. Bromelien) des bewohnten Habitates abgegeben werden, scheinen bei der en Orientierung eine wichtige Rolle zu spielen. Diese Gerüche zeichnen ein charakterisches Bild der Umgebung und scheinen vom Frosch als Orientierung beim Wiederauffinden des angestammten Reviers, zusätzlich zur räumlichen Orientierung, genutzt zu werden. Im Experiment waren die Frösche in der Lage, allein aufgrund des „heimatlichen“ Geruches, ihr Revier zu erkennen.
Balzverhalten:
Brutpflegeverhalten:
Lautäußerung (Vokalisation):

Foto: Rufendes Männchen Oophaga pumilio "Basitmentos"
© 2006 Holger Birkhahn
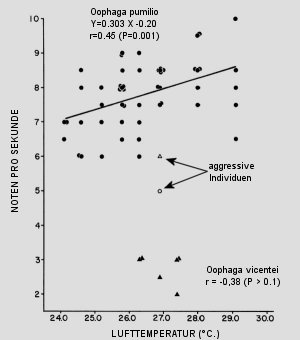
Abb.: Abhängigkeit der Rufrate von Temperatur und aggressivem Verhalten bei O. pumilio und O. vicentei. Verändert nach MYERS & DALY, 1979.
Oophaga pumilio "Colon" Lock bzw. Revieranzeigeruf, © 2003 Thorsten Mahn
Oophaga pumilio "Solarte" Balzruf, © 2004 M. Isensee
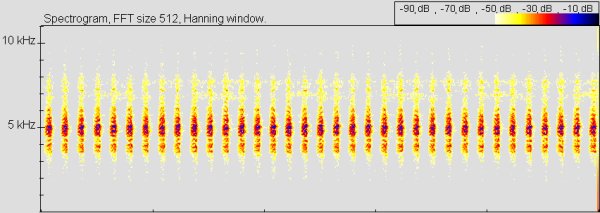
Sonagramm vergleichen:
| Lebensraum | Einklappen |
Verbreitung: | 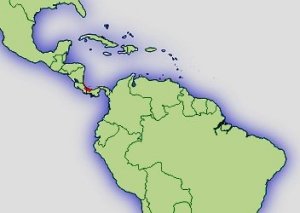 Abb.: ()Verbreitungsgebiet Oophaga pumilio © 2008 () |
Biotop:
Flächen mit mehr Lichteinfall (Sekundärwald, Pflanzungen, Rodungsflächen oder Strassenränder) erlauben ein besseres Wachstum der Bodenvegetation und der Epiphytenflora auch an unteren Stammbereichen. Damit steigt die Anzahl potentieller Brutpflanzen und direkt proportional auch die Populationsdichte von O. pumilio. Der Autor konnte in Costa Rica eine Rodungsfläche besuchen und über zwei Jahre den Verlauf der Populationsstruktur beobachten. Die Abstände zwischen einzelnen Revieren von O. pumilio s.l. (O. cf. typographa) lagen im Primärwald bei über 10 m. Man fand die Tiere meist paarweise assoziiert. Auf der angrenzenden Rodungsfläche betrug der Abstand zwischen den Tieren oft weniger als 2 m und man konnte auf ein Männchen etwa drei Weibchen nachweisen. Durch die vermehrt am Boden vorhandenen Bromelien (an gerodeten Bäumen) wuchs die Population innerhalb eines Jahres stark an. Zusätzlich wanderten Tiere aus dem angrenzenden Wald zu. Auch entlang von Straßen finden sich vielerorts dichte Heliconienbestände die dann oft einer großen O. pumilio-Population als Biotop dienen.
|
 Abb.: Entlang der Ufer kleiner Quebradas im Schutzgebiet Hitoy Cerere finden sich dichte Bestände von Brutpflanzen für O. pumilio. Prov. Limón, Costa Rica. © 2005 S. Becker |
|
Da die Art vermehrt in licht durchfluteten Biotopen zu finden ist wurde für eine optimale Haltung manchmal eine hohe Temperatur und starke UV-Strahlung als zwingend nötig prognostiziert. Messungen des Autors (OSTROWSKI, pers. Beobachtung) im Feld zeigten jedoch, dass die Art sonnige, heiße Stellen nicht bevorzugt sondern sich eher in schattigeren Bereichen mit Temperaturen um die 26° C aufhält. Auch bei verschiedenen Wetterlagen und in unterschiedlichen Biotopen waren an den bevorzugten Aufenthaltsplätzen rufender Tiere meist relativ konstante Temperaturen zu messen (s. Lichtmessungs- und Temperaturtabelle).
|
Tab.: Verschiedene Lichtstärken im Biotop von Oophaga pumilio. Dargestellt sind 30
representative Werte (ngesamt : 200; Mittelwert : 800 Lux).
|
||||||||||||||||||||||||||||||||||||||||||||||||||
Tab.: Temperaturmesswerte aus verschiedenen Biotopen von Oophaga pumilio bei verschiedenen Wetterlagen.
© 2006 OSTROWSKI
| Biotop | Sonneneinstrahlung | Wetter | H�he �ber NN [m] | H�he �ber Bodenniveau [m] | Jahreszeit | Uhrzeit | Temperatur [�C] |
| Bananenplantage | mittel | sonnig-leicht diesig | 70 | 0-0,5 | Invierno | 11:30 | 27 |
| Kakaoplantage | niedrig | heiter bis wolkig | 40 | 0-0,5 | Invierno | 13:00 | 25 |
| Kakaoplantage | niedrig | sonnig | 10 | 0-0,5 | Invierno | 13:30 | 26 |
| Waldrand | mittel | sonnig | 30 | 0-0,5 | Invierno | 14:30 | 26 |
| Kakaoplantage | mittel - hoch | nach Regen | 20 | 0-0,5 | Invierno | 11:00 | 26 |
| Baumgruppe | niedrig | bedeckt | 10 | 0-0,5 | Invierno | 14:30 | 26 |
| Sekund�rwald | niedrig | sonnig | 10 | 0-0,5 | Invierno | 11:30 | 26 |
| Sekund�rwald | niedrig | bedeckt | 20 | 0-0,5 | Invierno | 16:00 | 25 |
| Baumgruppe | mittel - hoch | bedeckt | 30 | 0-0,5 | Invierno | 10:00 | 24 |
| Kakaoplantage | niedrig | sonnig | 20 | 0-0,5 | Invierno | 13:00 | 26 |
Klima:
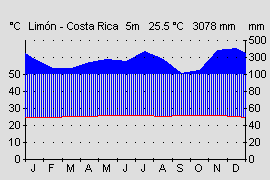 | 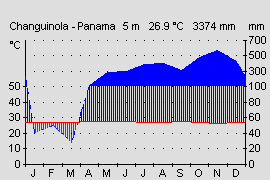 |
| Haltung im Terrarium | Einklappen |
automatische Beregnung und Nebelanlage empfehlenswert
Bodenbewohner, klettert oft und viel
Temperaturen:
Jahresschwankung: im Winter trockener halten
Jahrestemperaturschwankung minimal (1-2 °C)
Luftfeuchte:
Jahresschwankung: Regenzeit mit hoher Luftfeuchte und Regen zwischen Mai und September
Ernährung:
Besatz:
Gute Ergebnisse wurden mit den Kombinationen 1,1 und 1,2 erzielt. Bei mehreren Männchen kommt es zu Unterdrückungsritualen. In großen Becken auch Gruppenhaltung möglich. Zu viele Alttiere erschweren die Jungtieraufzucht.
Tipps zur Zucht:
Die Eiablage erfolgt auf glatten Blättern selten in Höhlen.
Legt 5-10 Eier
Entwicklungsdauer Eier: 10-14 Tage
Aktiver Transport der Quappen durch das Weibchen in sehr kleine Wasseransammlungen
Entwicklungsdauer der Quappen: 80-90 Tage Wassertemperatur bei 25°C, Nachtabsenkung empfohlen
Die Quappen werden vom Weibchen mit speziellen Futtereiern versorgt, künstliche Aufzucht mit Ersatzeiern artfremder Dendrobatiden möglich, aber mühselig. Für die Fütterung kommen Eier der Arten D. auratus, D. tinctorius, P. vittatus, P. bicolor, P. lugubris und E. tricolor in Frage. Da O. pumillio Larven die Gallerte von fremden Eier nicht durchfressen können muß man sie vor dem Füttern entfernen, ohne das die Frucht zerstört wird. Mit einer kleinen gebogenen Pinzette und auf dem trockenen ist es am einfachsten. Die Entwicklungszeit der Quappen ist bei der Aufzucht mit Fremdeiern länger und die Ausfallquote ist höher! Ausnahme: bei R. ventrimaculata Eiern dauert die Aufzucht auch nur 10 Wochen, Fütterung bis zu 2 mal die Woche.
Daher erfolgt die Aufzucht der Quappen und Jungtiere am besten mit den Eltern im Zuchtbecken. Zu früh entnommene Jungtiere (nicht vor 6 Mon.) stellen oft die Futteraufnahme ein und verenden.
Varianten in Terrarienhaltung:
| Aguacate |  |
| Aguacate (Buena Esperanza) |  |
| Almirante |  |
| Almirante (Vulture Point) |  |
| Bastimentos |  |
| Bisira |  |
| Bribri |  |
| Cayo de Agua |  |
| Cayo Sinnombre |  |
| Changuinola |  |
| Chiriqui Grande |  |
| Colón |  |
| Cristóbal |  |
| El Dorado |  |
| Guabo |  |
| Guarumo |  |
| Hitoy Cerere |  |
| Holotyp |  |
| Loma Partida |  |
| Pastores |  |
| Playa Segunda |  |
| Popa |  |
| Popa Dos |  |
| Popa Dos (Popa orange/Wilson´s Cay) |  |
| Punta Vieja |  |
| Rambala |  |
| Róbalo |  |
| Siquirres |  |
| Solarte |  |
stand 07.03.2026 00:20 Uhr
| Autoren dieser Seite: | Einklappen |
| Referenzen | Einklappen |
XX - Aquarien Magazin 12(6): 272-276
BEUTELSCHIESS, J. & C. BEUTELSCHIESS (1983): Dendrobates speciosus. - ein Rubin im Terrarium.
XX- herpetofauna, Weinstedt, 5 (25): 6-8
BIRKHAHN, H. (1991): Neue Erkenntnisse über die Aminosäureversorgung bei Dendrobatiden.
XX- herpetofauna, Weinstadt, 13 (74): 23-28.
BUNNEL, P. (1973): Vocalization in the Territorial Behavior of the Frog Dendrobates pumilio.
XX– Copeia No. 2: 277-284
CITES (2005): Convention on International Trade of Endangered Species of Wild Fauna and Flora.
XXOnlineversion: 11.08.05. Electronic Database accessible at http://www.cites.org/index.html
DONNELLY, M.A. (1989): Effects of reproductive resource supplementation on space-use patterns in
XXDendrobates pumilio. – Oecologia 81: 212-218
FORESTER, D.C. & A. WISNIESKI (1991): The Significance of Airborne Olfactory Cues to the Recognition
XX of Home Area by the Dart-poison Frog Dendrobates pumilio. - Journal of Herpetology. 25(4): 502-504.
FRITZ, G. , RAND, A.S. & C. W. DE PAMPHILIS (1981): The aposematically colored frog,
XX Dendrobates pumilo, is distasteful to the large, predatory ant, Paraponera clavata.
XX- Biotropica 13 (2): 158-159.
FROST, D.R. (2007): Amphibian Species of the World: an Online Reference. Version 5.0 (1.02.2007).
XXElectronic Database accessible at http://research.amnh.org/herpetology/amphibia/index.php
XX Am.Mus.Nat.Hist. New York, USA.
GOSNER, K.L. (1960): A Simplified Table for Staging Anuran Embryos and Larvae.
XX-Herpetologica, 16: 183-190
GRANT, T . , FROST, D. R. , CALDWELL, J. P. , GAGLIARDO, R. , HADDAD, C. F. B. , KOK, P. J. R. ,
XXMEANS, D.B. , NOONAN, B. P. , SCHARGEL, W. E. & W.C. WHEELER (2006): Phylogenetic
XXsystematics of dart-poison frogs and their relatives (Amphibia, Athesphatanura, Dendrobatidae).
XX - Bulletin of the Am.Mus.Nat.Hist. 299. (PDF)
HAASE, A. & H. PRÖHL (2002): Female activity patterns and aggressiveness in the Strawberry Poison
XXFrog Dendrobates pumilio (Anura: Dendrobatidae). - Amphibia- Reptilia 23:129–140.
HAGEMANN S, & H. PRÖHL (2007): Mitochondrial paraphyly in a polymorphic poison frog species
XX(Dendrobatidae; D. pumilio). - Molecular Phylogenetics & Evolution 45(2): 740-747
HAGEMANN, S. (2005): Genetische Variation beim Erdbeerfröschen (Dendrobates pumilio) in Costa Rica
XXund Panama. – Diplomarbeit, 2005. Institut für Zoologie, Tierärztlichen Hochschule Hannover.
IUCN, Conservation International, and NatureServe. (2009): Global Amphibian Assessment.
XXwww.globalamphibians.org. Downloaded on 15 October 2004.
KARSCH, J. (2004): Geographische Variation in bioakustischen Signalen beim Erdbeerfröschchen
XXDendrobates pumilio – Diplomarbeit, Institut für Zoologie der Tierärztlichen Hochschule Hannover.
KEFERSTEIN, W. (1867): Ueber einige neue oder seltene Batrachier aus Australien und dem tropischen
XX Amerika. - Nachrichten von der Georg-Augusts Universität und der Königlichen Gesellschaft
XX der Wissenschaften zu Göttingen 18: 341-361
MASTER, T.L. (1999): Predation by Rufous Motmot on Black-and-Green Poison Dart Frog
XX- Wilson Bull., 11 l (3): 439-440
MYERS, C.W. & J. W. DALY (1976): Preliminary Evaluation of Skin Toxins and Vocalizations in
XX Taxonomic and Evolutionary Studies of Poison-Dart Frogs (Dendrobatidae).
XX- Bulletin Of The American Museum Of Natural History 157 (3).
OSTROWSKI, T. (2007): Territorialverhalten bei aposematisch und kryptisch gefärbten Populationen von
XXOophaga pumilio (Anura, Dendrobatidae). – Hausarbeit im Rahmen der Ersten Staatsprüfung für das
XXLehramt Gymnasium (Biologie/Chemie). Institut für Zoologie, Tierärztlichen Hochschule Hannover
XXund Fachbereich Biologie, Universität Hannover.
PRÖHL, H. & O. BERKE (2001): Spatial distributions of male and female strawberry poison frogs and their
XXrelation to female reproductive resources. - Oecologia 129: 534–542
PRÖHL, H. & W. HÖDL (1999): Parental investment, potential reproductive rates, and mating system
XXin the strawberry dart-poison frog, Dendrobates pumilio. - Behav Ecol Sociobiol 46: 215 - 220
PRÖHL, H. (2002): Population differences in female resource abundance, adult sex ratio, and male
XXmating success in Dendrobates pumilio. - Behav Ecol 13(2): 175-181.
PRÖHL, H. (2003): Variation in Male Calling Behaviour and Relation to Male Mating Success in the
XXStrawberry Poison Frog (Dendrobates pumilio. - Ethology 109: 273-290
PRÖHL, H. (2005): Clutch loss affects the operational sex ratio in the strawberry poison frog
XXDendrobates pumilio. - Behav Ecol Sociobiol 58: 310–315
PRÖHL, H. (2005): Territorial Behavior in Dendrobatid Frogs. - Journal of Herpetology 39(3): 354–365.
PRÖHL, H. , HAGEMANN, S. , KARSCH, J. & G. HÖBEL (submitted): Geographic advertisement call variation
XXin the strawberry poison frog Dendrobates pumilio. - Ethology
PRÖHL, H. , HAGEMANN, S. , KARSCH, J. & G. HÖBEL (submitted): Geographic variation in sexual traits in
XXstrawberry poison frogs (Dendrobates pumilio). - Ethology
RUDH, A. (2006): Genetic structure among color morphs of the Strawberry poison frog (Dendrobates
XX pumilio). - Degree projekt in biology. Examensarbete i biologi, 20 p (10 p), HT 2005.
XX Biology Education Centre and Department of Population Biology, Uppsala University. (PDF)
SAPORITO, R.A., GARRAFFO, H.M., DONNELLY, M.A. , EDWARDS, A.L., LONGINO, J.T., & J.W. DALY (2004):
XXFormicine ants: An arthropod source for the pumiliotoxin alkaloids of dendrobatid poison frogs.
XX- Proc.Nat.Acad.Sci USA 101 (21):8045-8050
SPANDE T.F., POONAM, J., GARAFFO, H.M., PANNELL, L.K., YEH, H.J.C. & J. DALY (1999): Occurence
XXand significance of Decahydroquinolines from Dendrobatid Poison Frogs and a Myrmecine Ant:
XXUse of 1H an 13C NMR in their conformational analysis. - J.Nat.Prod. 1999 (62): 5-21
SUMMERS, K. (1999): Dendrobates auratus (Green Poison Frog) predation.
XX- Herpetological Rewiew 30 (2): 91
SZELISTOWSKI, W.A. (1985): Unpalatability of the poison arrow frog Dendrobates pumilio to the
XXctenid spider, Cupiennius coccineus. - Biotropica 17(4): 345-346
WALTER, H. & S. BRECKLE (1999): Vegetationen und Klimazonen. 7. Auflage. - Ulmer, Stuttgart.
WEYGOLD, P. (1980): Complex Broodcare and reproductive behavior in captive poison-arrow frogs,
XXDendrobates pumilio O. Schmidt. - Behav Ecol Sociobiol 7: 329-332
WEYGOLD, P. (1984): Beobachtungen zur Fortpflanzungsbiologie von Dendrobates pumilio
XX Schmidt, 1897 im Terrarium (Salientia: Dendrobatidae). - Salamandra 20: 112-120
| Zitierung: | Einklappen |
- Dendrobase.de - Eine Online-Datenbank der Familie Dendrobatidae (Anura).
https://www.dendrobase.de/html/D_oophaga_pumilio.html; Stand: März 2026
| Link für Website Betreiber: | Einklappen |
- Die Website enthält weder illegale, rassistische oder sexistische Inhalte
- Das Thema der Website bezieht sich auf Frösche
- Der Link genau wie folgend angegeben verwendet wird:
<a href="https://www.dendrobase.de/html/D_oophaga_pumilio.html" target="_new">Oophaga pumilio (DendroBase.de)</a>
| Fotos | Einklappen |

Oophaga ()pumilio "Siquirres"
© 2006 Holger Birkhahn

Oophaga ()pumilio
"Siquirres"
© 2006 ()

Oophaga ()pumilio
"Hitoy Cerere"
© 2005 ()

Oophaga ()pumilio
"Bribri"
(Puerto Viejo)
© 2005 ()

Oophaga ()pumilio
"Fila Carbon"
© 2007 ()

Oophaga ()pumilio
"Fila Carbon"
© 2007 ()

Oophaga ()pumilio
"Bribri"
(Manzanillo)
© 2004 Michael Bollhorn

Oophaga ()pumilio
"Bribri"
(Shiroles)
© 2007 Kay-Uwe Stolarski

Oophaga ()pumilio
"Changuinola"
© 2008 Max Bjørneskov

Oophaga ()pumilio
"Almirante"
(Valle Risco)
© 2008 Max Bjørneskov

Oophaga ()pumilio
"Almirante"
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Almirante"
© 2007 ()

Oophaga ()pumilio
"Pastores"
© 2005 ()

Oophaga ()pumilio
"Pastores"
© 2007 ()

Oophaga ()pumilio
"Pastores"
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Pastores"
© 2008 ()

Oophaga ()pumilio
"Pastores"
© 2008 ()

Oophaga ()pumilio
"Róbalo"
(Río La Gloria)
© 2007 ()

Oophaga ()pumilio
"Róbalo"
(Río La Gloria)
© 2002 ()

Oophaga ()pumilio
"Róbalo"
(Quebrada Cascaje)
© 2007 ()

Oophaga ()pumilio
"Róbalo"
(Quebrada Cascaje)
© 2007 ()

Oophaga ()pumilio
"Róbalo"
(Quebrada Cascaje)
© 2007 ()

Oophaga ()pumilio
"Róbalo"
(Quebrada Cascaje)
© 2007 ()

Oophaga ()pumilio
"Róbalo"
(Quebrada Cascaje)
© 2005 Holger Birkhahn

Oophaga ()pumilio
"Cristóbal"
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Cristóbal"
© 2006 H.W. van Boeijen

Oophaga ()pumilio
"Cristóbal"
© 2008 ()

Oophaga ()pumilio
"Cristóbal"
© 2008 ()

Oophaga ()pumilio
"Colón"
(Playa Paunch)
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Colón"
(Boca del Drago)
© 2007 ()

Oophaga ()pumilio
"Colón"
(Boca del Drago)
© 2007 ()

Oophaga ()pumilio
"Colón"
(Boca del Drago)
© 2007 ()

Oophaga ()pumilio
"Colon"
(La Gruta)
© 2007 ()

Oophaga ()pumilio
"Colon"
(La Gruta)
© 2007 ()

Oophaga ()pumilio
"Solarte"
© 2007 ()

Oophaga ()pumilio
"Solarte"
© 2005 ()

Oophaga ()pumilio
"Solarte"
♀ mit Larve
© 2007 ()

Oophaga ()pumilio
"Solarte"
mit abweichender Färbung
© 2007 ()

Oophaga ()pumilio
"Bastimentos"
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Bastimentos"
© 2008 ()

Oophaga ()pumilio
"Bastimentos"
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Bastimentos"
♀ mit Larve
© 2007 ()

Oophaga ()pumilio
"Bastimentos"
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Bastimentos"
© 2005 ()

Oophaga ()pumilio
"Bastimentos"
© 2002 ()
Ventralseite
© 2005 ()

Oophaga ()pumilio
"Bastimentos"
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Bastimentos"
© 2005 ()

Oophaga ()pumilio
"Bastimentos"
© 2008 ()

Rufendes ()Männchen der Art Oophaga pumilio
"Bastimentos"
© 2008 ()

Oophaga ()pumilio
"Playa Segunda", Bastimentos
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Playa Larga"
Bastimentos, Panama
© 2007 ()

Oophaga ()pumilio
"Punta Vieja"
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Punta Vieja"
© 2008 ()

Oophaga ()pumilio
"Punta Vieja"
© 2008 ()

Oophaga ()pumilio
"Cayo Sinnombre"
© 2008 ()

Oophaga ()pumilio
"Cayo Sinnombre"
© 2008 ()

Oophaga ()pumilio
"Isla Sinnombre"
© 2008 Max Bjørneskov

Oophaga ()pumilio
"Isla Sinnombre"
© 2008 Max Bjørneskov

Oophaga ()pumilio
"Isla Sinnombre"
© 2008 Max Bjørneskov

Oophaga ()pumilio
"Popa Dos"
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Popa Dos"
© 2008 ()

Oophaga ()pumilio
"Popa Dos"
© 2008 ()

Oophaga ()pumilio
"Popa"
© 2004 ()

Jungfrosch ()der "Popa"-Variante beim Landgang
© ()

Oophaga ()pumilio
"Loma Partida"
© 2007 ()

Oophaga ()pumilio
"Loma Partida"
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Cayo de Agua"
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Guarumo"
(Rio Branco)
© 2005 Thomas Fuchs

Oophaga ()pumilio
"Guarumo"
(Río La Gloria)
© 2007 ()

Oophaga ()pumilio
"Guarumo"
© 2007 ()

Oophaga ()pumilio
"Guarumo"
© 2007 ()

Oophaga ()pumilio
"Guarumo"
© 2005 ()

Oophaga ()pumilio
"Guarumo"
Tier mit seltener Fehlfarbe, Biotopaufnahme
© 2008 ()

Oophaga ()pumilio
"Guabo"
© 2002 ()

Oophaga ()pumilio
"Guabo"
© 2007 ()

Oophaga ()pumilio
"Guabo"
© 2007 ()

Oophaga ()pumilio
"Rambala"
© 2005 ()

Oophaga ()pumilio
"Rambala"
© 2005 ()

Oophaga ()pumilio
"Rambala"
© 2008 ()

Oophaga ()pumilio
"Rambala"
© 2008 ()

Oophaga ()pumilio
"Chiriqui Grande"
© 2004 ()

Oophaga ()pumilio
"Aguacate"
(Cauchero)
© 2004 Sabine Hagemann

Oophaga ()pumilio
"Aguacate"
(Cauchero)
© 2006 Sabine Hagemann

Oophaga ()pumilio
"Aguacate"
(Cerro Brucho)
© 2002 ()

Oophaga ()pumilio
"Aguacate"
(Tierra Oscura)
© 2005 Sabine Hagemann

Oophaga ()pumilio
"Aguacate"
(Tierra Oscura)
© 2007 ()

Oophaga ()pumilio
"Aguacate"
(Tierra Oscura)
© 2007 ()

Oophaga ()pumilio
"Aguacate"
(Tierra Oscura)
© 2008 ()

Oophaga ()pumilio
"Aguacate"
(Tierra Oscura)
© 2008 ()

Oophaga ()pumilio
"Aguacate"
(Buena Esperanza)
© 2008 ()

Oophaga ()pumilio
"Aguacate"
(Buena Esperanza)
© 2008 ()

Oophaga ()pumilio
"Aguacate"
(Buena Esperanza)
© 2008 ()

Oophaga ()pumilio
"Aguacate"
(Buena Esperanza)
© 2008 Max Bjørneskov

Oophaga ()pumilio
"Aguacate"
(Buena Esperanza)
© 2008 Max Bjørneskov

Oophaga ()pumilio "Bisira"
© 2007 ()

Oophaga ()pumilio "Bisira"
© 2007 ()














































