| Login | Einklappen |
Startseite
Artbeschreibungen
Allobates
Anomaloglossus
Rheobates
Aromobates
Mannophryne
Ameerega
Colostethus
Epipedobates
Silverstoneia
Andinobates
Adelphobates
Dendrobates
Excidobates
Minyobates
Oophaga
Phyllobates
Ranitomeya
Hyloxalus
Foren
Inserate
Reportagen
Service & Links
Einstellungen
| Fotos von Nutzern | Einklappen |
| Nomenklatur | Einklappen |
wissenschaftl. Name: Dendrobates auratus (GIRARD, 1855)
Etymologie:
Synonyme:
Dendrobates tinctorius auratus (LAURENT, 1942)
Hylaplesia tinctoria latimaculata (DUNN, 1941)
Dendrobates auratus (DUNN, 1931)
Dendrobates amoenus (WERNER, 1901)
Dendrobates trivittatus auratus (PETERS, 1874)
Dendrobates tinctorius var. auratus (STEINDACHNER, 1864)
Hylaplesia aurata (COPE, 1863)
Dendrobates latimaculatus (GÜNTHER, 1859)
Phyllobates auratus (GIRARD, 1855)
FROST (2006)
englischer Name: Green Poison Frog (CITES)
deutscher Name: Goldbaumsteiger
spanischer Name: Ranita venenosa verdinegra
französischer Name: Dendrobate doré
niederländischer Name: Gouden gifkikker
Etymologie:
Das auratus ist lateinisches Adjektiv für "vergoldet" (aureum = Gold). Es nimmt Bezug auf die Tatsache, dass einige Varianten metallisch glänzen und ihre Färbung im Sonnenlicht bronze bis matt golden erscheint. Einige Individuen besitzen goldene oder silberne Pigmente, die auch bei konservierten Exemplaren eine Zeit lang erhalten bleiben. Nach SAVAGE (1968) führten wohl solche Pigmente konservierter Tiere zur Namensgebung durch GIRARD (1855).
Synonyme:
Dendrobates tinctorius auratus (LAURENT, 1942)
Hylaplesia tinctoria latimaculata (DUNN, 1941)
Dendrobates auratus (DUNN, 1931)
Dendrobates amoenus (WERNER, 1901)
Dendrobates trivittatus auratus (PETERS, 1874)
Dendrobates tinctorius var. auratus (STEINDACHNER, 1864)
Hylaplesia aurata (COPE, 1863)
Dendrobates latimaculatus (GÜNTHER, 1859)
Phyllobates auratus (GIRARD, 1855)
FROST (2006)
englischer Name: Green Poison Frog (CITES)
deutscher Name: Goldbaumsteiger
spanischer Name: Ranita venenosa verdinegra
französischer Name: Dendrobate doré
niederländischer Name: Gouden gifkikker
| Systematik | Einklappen |
Klassifizierung:
Amphibia->Anura->Dendrobatoidea->Dendrobatidae->Dendrobatinae->Dendrobates->Dendrobates auratus (GIRARD, 1855)
Gruppe:
Anmerkung zur Systematik:
Amphibia->Anura->Dendrobatoidea->Dendrobatidae->Dendrobatinae->Dendrobates->Dendrobates auratus (GIRARD, 1855)
Gruppe:
Die Gattung Dendrobates entspricht weitestgehend der Tinctorius- und Auratus-Gruppe im Sinne von SILVERSTONE (1975)
Anmerkung zur Systematik:
Nach neuesten genetischen, morphologischen und ethologischen Erkenntnissen von GRANT ET AL. (2006) wurde eine umfangreiche Neuordnung der Familie Dendrobatidae vorgenommen. In der ehemals großen Gattung Dendrobates verbleiben einzig die Arten der Dendrobates tinctorius- und Dendrobates auratus-Gruppe nach SILVERSTONE (1975). Ausgenommen ist Dendrobates galactonotus der im Zuge der neuen Systematik in die neue Gattung Adelphobates überstellt wurde (GRANT ET AL., 2006).
| Bedrohungsstatus | Einklappen |
Laut IUCN (2008) wird die Art in der Roten Liste aufgrund des großen Verbreitungsgebietes, der großen Anpassungsfähigkeit bei Habitatveränderungen und der vermutlich großen Populationsdichte als nicht gefährdet eingestuft. Der Tierhandel dürfte nur noch ein untergeordnetes Gefährdungspotenzial für die Wildpopulationen darstellen (<75%), da die Art regelmäßig und in großen Mengen nachgezogen wird. Die Gefärdung einiger kleinerer Subpopulationen durch Habitatverlust und kommerziellen Handel ist jedoch nicht auszuschließen. Die Art kommt in mehreren staatlichen Schutzgebieten vor (z.B. Parque Nacional Soberania).
Laut CITES (2008) wurde die Art regelmäßig legal ausgeführt und gehandelt.
Anhang II des WA. Anhang B der EU-ArtSchVO(EG). Nach BArtSchVO besteht Zuchtbuch- und Nachweispflicht jedoch seit 2005 keine Meldepflicht mehr.
Laut CITES (2008) wurde die Art regelmäßig legal ausgeführt und gehandelt.
Anhang II des WA. Anhang B der EU-ArtSchVO(EG). Nach BArtSchVO besteht Zuchtbuch- und Nachweispflicht jedoch seit 2005 keine Meldepflicht mehr.
| Beschreibung | Einklappen |
| Größe Mittelgroße bis große Dendrobates Art mit einer von 28-55 mm. |  © 2008 Thorsten Mahn |
Haut glatt. Grundfarbe schwarz bis braun oder braun-bronze mit weißer, beiger, gelbgrüner, grüner, türkiser oder blauer Musterung. Haftscheiben der Finger vergrößert, bei manchen Populationen bei den Männchen größer als bei den Weibchen. Merkmal aber nicht immer sicher. Weibchen meist mit größerer Körperlänge und Umfang.
Variation:
Verschiedene farbpolymorphe Populationen sind bekannt. 1968 führte SAVAGE und 1975 auch SILVERSTONE in seiner Revision der Gattung Dendrobates viele verschiedene Fundorte der Art an. BIRKHAHN ET AL. (1994) besuchten auf drei Reisen einige dieser Fundorte und konnten viele Populationen erstmals fotografisch dokumentieren. Besonders bemerkenswert erscheinen die Funde einer Population mit weißer Zeichnung (BIRKHAHN ET AL., 1994). Im Jahr 2004 tauchten bei Terrarianern Tiere auf, die keine schwarze oder braune Grundfarbe mehr zeigen sondern flächig gelb gefärbt sind. Die Herkunft dieser Farbmorphe bleibt unbekannt, sie sollen jedoch aus Panama stammen. Auf Grundlage der oben genannten Autoren, Hinweisen von PIPER (pers. Mitteilung) und eigenen Beobachtungen des Autors (OSTROWSKI, pers. Beobachtung) haben wir die nachfolgende Farbmorphen-Populations-Tabelle erstellt. Die dabei gewählten Namen sollen eine Einordnung des Vorkommens in eine geografische bzw. klimatische Region erleichtern, ohne dabei den genauen Fundort anzugeben. Die Namen stehen meist für Orte oder Flüsse, in deren (nicht unbedingt unmittelbaren) Umgebung die Populationen gefunden wurden. Bei konsequenter Bezeichnung der Morphen mit diesen Namen können Hybriden zwischen morphologisch ähnlichen Populationen weit auseinander liegender Vorkommen vermieden werden. Das von BIRKHAHN ET AL. (1994) vorgeschlagene Bezeichnungssystem mit Buchstaben- Zahlencode, wie in der Aquaristik üblich, erscheint uns nicht sinnvoll, da durch diese auch eine nur grobe geografische Zuordnung nicht zu treffen ist und Klima- und Biotopdaten der Gebiete für eine optimale Haltung somit nicht herangezogen werden können. Einige Namen von Farbmorpen, wie z.B. "Taboga" oder "Colón", haben sich außerdem bereits gut etabliert und sollten nicht durch kryptische Codes ersetzt werden. Die Bezeichnungen "EL Oro", "Bronce" und "Punta Pequeña"(Microspot) bezeichnen keine Fundorte von Populationen, sondern beziehen sich auf deren Zeichnungs- bzw. Färbungsmuster. Für diese Populationen sind DendroBase keine Fundorte bekannt oder werden aus Schutzgründen nicht angegeben. Achtung!!! Die als "Nominat" bezeichneten Tiere (manchmal aus Costa Rica, manchmal aus Panama), sollten besser als "Karibikseite" bezeichnet werden. Der Typenfundort der Art Dendrobates auratus liegt auf der Isla Taboga im Golf von Panama und somit müsste man diese Variante als "Nominat" bezeichnen. Da für Dendrobatiden jedoch keine Unterarten anerkannt werden, gibt es auch keine Nominat-Formen (wie möglicherweise Dendrobates auratus auratus) gegenüber später beschriebenen Unterarten. Die Farbmorphe von Taboga entspricht daher dem Holotypus aber nicht einer Nominatform.
Tab.: Namen, Größenangaben und Farbmusterverteilung verschiedener Populationen von Dendrobates auratus
14-17 Jahre
Geschlechtsreife:
Mit 12-15 Monaten. Männchen werden oft eher geschlechtsreif als Weibchen und beginnen schon 2-3 Monate vor der ersten Eiablage mit dem Rufen. Oftmals verpilzen die ersten Gelege von gerade Geschlechtsreif gewordenen Tieren (OSTROWSKI & MAHN pers. Beobachtung).
Hautgifte:
Die Hautgifte der Pfeilgiftfrösche gehören zu den -en. Hauptbestandteile des Hauttoxins von D. auratus sind nach DALY ET AL. (1992): e, -A- Toxine, e und e. Die Forscher um DALY wiesen 36 verschiedene Gifte in vier Populationen von D. auratus nach. Dabei unterschieden sich die Populationen (El Copé, Taboga, Karibikseite Costa Rica und Hawaii) deutlich in ihrer Giftkomposition. Am interessantesten war die Tatsache, dass die ursprünglich von Taboga stammenden Tiere aus Hawaii in ihrer Giftzusammensetzung nicht mit den Tieren von Taboga übereinstimmten. Im Gegensatz zu der Taboga-Variante fehlten der Hawaii-Variante Histrionicotoxine. Sie besaßen dafür eine völlig andere Giftklasse, die bei keiner der mittelamerikanischen Varianten vorkam. Die Zusammensetzung der Gifte ist also offensichtlich nicht genetisch festgelegt. Außerdem scheinen die Frösche ihre Gifte nicht selbst im Körper zu produzieren, da im Terrarium aufgezogene Nachzuchten aller vier Varianten keine messbaren Giftmengen enthielten (DALY ET AL., 1992). In Hawaii unter Freilandbedingungen aufgezogene Nachzuchten der Hawaii-Variante zeigten, bei überwiegender Ernährung mit im Freiland gefangenen Insekten (Drosophila und Termiten), eine Toxinzusammensetzung wie Wildfangtiere. Die Giftkonzentration war jedoch geringer als bei freilebenden Tieren. Fütterungsexperimente an D. auratus von DALY ET AL. (1994), in denen Fruchtfliegen mit Alkaloidpulver bestäubt wurden, ergaben eine Anreicherung dieser Gifte in der Haut wo sie mehrere Monate nachweisbar blieben. Die Gifte werden also wohl mit der Nahrung aufgenommen, und die Zusammensetzung der Gifte scheint hauptsächlich abhängig vom Beutespektrum zu sein. Auch neuere Forschungsergebnisse, bei denen Alkaloide auch in Insekten aus dem Beutespektrum nachgewiesen wurden, stützen diese Hypothese (SPANDE ET AL, 1999 und SAPORITO ET AL, 2004).
D. auratus gehört, trotz der hochgiftigen Einzelkomponenten die aber nur in vergleichsweise geringer Konzentration vorliegen, zu den weniger giftigen Arten. Trotz seiner Hauttoxine gehört er zum Beutespektrum verschiedener en. SUMMERS (1999) beobachtete Prädation durch die Vogelspinnenart (Sericopelma rubronites). OSTROWSKI (pers. Beobachtung) konnte dieses auf der Isla Taboga ebenfalls beobachten und fotografisch dokumentieren (Abb.3). Die Spinnen verzehrten die Frösche vollständig und das Gift hatte keine sichtbaren Folgen. Eine nach dem Verzehr eines D. auratus von SUMMERS gefangene Spinne, zeigte auch 2 Tagen später im Terrarium keinerlei Irritationen durch die Toxine. Auch vom Zimtbrustmotmot (Baryphthengus martii) einer Vogelart aus der Familie der Sägeracken (Momotidae) liegen Beobachtungen über Prädation an D. auratus vor (MASTER, 1999). Ein Vogel wurde bei der Übergabe eines erbeuteten D. auratus an seinen Partner beobachtet (Werbeverhalten). Dieser verzehrte den Frosch sofort. Auch nach 30 min zeigte keiner der Vögel Anzeichen einer Vergiftung. Der Verzehr eines Frosches, dessen Farben als Warntracht gilt, erscheint insofern verwunderlich, da die Vögel Farben gut erkennen können .
D. auratus gehört, trotz der hochgiftigen Einzelkomponenten die aber nur in vergleichsweise geringer Konzentration vorliegen, zu den weniger giftigen Arten. Trotz seiner Hauttoxine gehört er zum Beutespektrum verschiedener en. SUMMERS (1999) beobachtete Prädation durch die Vogelspinnenart (Sericopelma rubronites). OSTROWSKI (pers. Beobachtung) konnte dieses auf der Isla Taboga ebenfalls beobachten und fotografisch dokumentieren (Abb.3). Die Spinnen verzehrten die Frösche vollständig und das Gift hatte keine sichtbaren Folgen. Eine nach dem Verzehr eines D. auratus von SUMMERS gefangene Spinne, zeigte auch 2 Tagen später im Terrarium keinerlei Irritationen durch die Toxine. Auch vom Zimtbrustmotmot (Baryphthengus martii) einer Vogelart aus der Familie der Sägeracken (Momotidae) liegen Beobachtungen über Prädation an D. auratus vor (MASTER, 1999). Ein Vogel wurde bei der Übergabe eines erbeuteten D. auratus an seinen Partner beobachtet (Werbeverhalten). Dieser verzehrte den Frosch sofort. Auch nach 30 min zeigte keiner der Vögel Anzeichen einer Vergiftung. Der Verzehr eines Frosches, dessen Farben als Warntracht gilt, erscheint insofern verwunderlich, da die Vögel Farben gut erkennen können .
 Abb.1: Motmots, hier Electron platyrhynchum, erbeuten kleine Wirbeltiere, unter anderem auch D. auratus © 2005 Michael Werner |
 Abb.2: Die Vogelspinne Sericopelma rubronites hat einen D. auratus erbeutet und zieht sich zur Verdauung in ihren Unterschlupf zurück. © 2005 Thomas Ostrowski |
| Gelege und Larven | Einklappen |
Merkmale Gelege:
Merkmale Larven:
vergleichen mit:
Entwicklungszeiten:
Ernährung:
Im Mittel liegt die Gelegegröße bei 5-8 Eier, kann aber bei Tieren von der Karibikseite auch bis zu 12 Eier betragen. Der Eidurchmesser beträgt 2,8 mm (OSTROWSKI, pers. Beobachtung).
Merkmale Larven:
Die Larve von D. auratus ist neben der von D. tinctorius eine der Größten in der Familie Dendrobatidae. Sie erreichen bei guter Ernährung Gesamtlängen von bis zu 40 mm. : Der Körper ist kräftig, ca. 1,7-mal länger als breit und ca. 1,7-mal breiter als hoch. Der Schwanz macht über die Hälfte der Gesamtlänge aus (60-70%). Die Quappe ist einfarbig schwarz gefärbt. Die Flossensäume sind durchscheinend hellgrau. Augen und Nasenlöcher liegen . Die ist nach SAVGE (2002) klein und vollständig bezahnt ( und n). Zwei Zahnreihen (Dentikelreihen) oberhalb () des Hornschnabels und drei unterhalb (). Dentikelformel: 2/3. Reihe A2 mit Lücke. Am Unterrand der Mundscheibe zwei Reihen kleiner Papillen (s.Abb.4). Das (Atemrohr) liegt u. .
Eine vom Autor vermessene Quappe der Taboga-Variante hatte im Stadium 40 nach GOSNER folgende Körpermaße: Körperlänge: 14 mm; Gesamtlänge: 32 mm; Körperbreite hinter Vorderbeintaschen: 8 mm; Körperhöhe: 4,5 mm; Schwanzhöhe: 2,5 mm mit Flossensäumen 5 mm (OSTROWSKI, pers. Beobachtungen).
GRAY und CHRISTY berichten von Prädation duch Krabben (Armases angustum) die in Asthöhlen mit leben. (GRAY und CHRISTY, 2000)
GRAY und CHRISTY berichten von Prädation duch Krabben (Armases angustum) die in Asthöhlen mit leben. (GRAY und CHRISTY, 2000)
 Abb.: (5)Mundfeld der Larve von D. auratus. Nach SAVAGE (2002) © 2005 Thomas Ostrowski (0) Mundfeld vergleichen: |  Abb.: (5)Larve Dendrobates auratus © 2008 Thomas Ostrowski (0) |
Entwicklungszeiten:
Die Gelege benötigen je nach Teperatur 12-16 Tage bis zum Schlupf. Die Hinterbeine durchbrechen etwa 25-30 Tage nach dem Schlupf die Beintaschen, die Vorderbeine nach etwa 50-60 Tagen. Beim Autor entwickeln sich die Quappen bei guter (täglicher) Fütterung und 24° C Wassertemperatur innerhalb von 55-65 Tagen nach dem Schlupf zum fertigen Jungfrosch.(OSTROWSKI, pers. Beobachtung).
Ernährung:
Die Larven von D. auratus ernähren sich im Freiland hauptsächlich . Untersuchungen in wassergefüllten Baumhöhlen ergaben, dass die Larven von D. auratus hauptsächlich Mosquitolarven fressen und um Ihre Beute mit Libellenlarven konkurrieren. In diesen Microhabitaten haben sie die wichtige Funktion des Prädators am Ende der Nahrungskette. (FINCHE ET AL., 1997 und YANOVIAK, 2001). Generell sind die Larven aber und nehmen auch andere Futtersorten an. Sie lassen sich unter Terraienbedingungen ohne Probleme mit Zierfischtrockenfutter ernähren. Der Autor machte gute Erfahrungen mit einem fein zermahlenem Gemisch aus Zierfischtrockenfutter (Farbfutter), gefriergetrockneten Bachflohkrebsen, Roten Mückenlarven, Wasserflöhen, Artemia und Spirulina haltigen Futtertabletten für Zierfische (OSTROWSKI, pers. Beobachtung).
| Verhalten (Ethologie) | Einklappen |
Allgemeines Verhalten:
Revierverhalten:
Balzverhalten:
Brutpflegeverhalten: 
Abb.8: Larventragendes Männchen. © 2005 Ivonne Meuche
Nach dem Laichen übernimmt das Männchen alleine die Brutpflege. Es bewässert regelmäßig die Eier. Dazu nimmt es vorher Wasser an feuchten Stellen auf. WELLS (1978) beobachtete ein Männchen das 3 Mal in 95 min ein Gelege besuchte und vorher immer 10 -15 min auf einem nassen Stein in einer Pfütze saß. Um das Gelege zu befeuchten bewegt sich das Männchen auf dem Gelege in Kreisen und bearbeitet die Gallertmasse mit den Füßen, dabei gibt es Wasser über Haut und Blase ab. Sind die Quappen nach 10-16 Tagen geschlüpft, nimmt es die Larven meist einzeln auf den Rücken auf. Dazu sitzt das Männchen mit u-förmig nach unten durchgebogenem Rücken im Gelege (Schüsselstellung nach JUNGFER, 1985). Die Larven schlängeln sich nun entlang der Hinterbeine selten entlang der Flanken auf den Rücken. Die Larven werden meist einzeln aber manchmal auch zu mehreren transportiert (s. Abb.8).

Abb.9: Natürliche und künstliche Absatzstellen für Larven von D.auratus. © 2005 T. Ostrowski
Das Männchen setzt die Larven meist in Baumhöhlen ab. Aber auch andere ta, wie z.B. wassergefüllte Bromelienachseln werden benutzt. Dabei klettern Männchen durchaus höher an Bäumen hinauf. Männchen sind nicht wählerisch bei der Auswahl der Absatzgewässer. Auf Taboga konnten Quappen in künstlichen Kleinstgewässern in Autoreifen, Plastikplanen, alten Farbeimern, Blechdosen und Gläsern (s. Abb.9) nachgewiesen werden (OSTROWSKI, pers. Beobachtung). Oft benutzen Männchen für ihre Gelege immer wieder die gleichen Absatzstellen. Bei Mangel an Wasseransammlungen setzen alle Männchen eines Gebietes ihre Larven im Extremfall in nur einer einzige Wasserstelle ab. Man findet in solchen Wasseransammlungen dann viele Larven in unterschiedlichen Entwicklungsstadien. Bei Futtermangel kommt es in solch stark besetzten Wasseransammlungen zu Kannibalismus unter den Larven. Männchen können mehrere Gelege gleichzeitig betreuen. Diese Brutverschränkung kommt auch bei anderen Dendrobates Arten vor (JUNGFER, 1985). WELLS (1978) berichtet von einem Männchen das gleichzeitig 2 Gelege mit ca. 10 Tagen Abstand betreute.
Lautäußerung (Vokalisation):
Sound: Anzeigeruf von Dendrobates auratus. © 2006 T. Mahn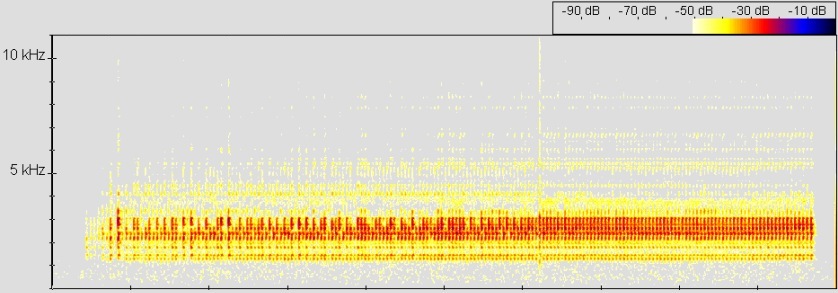
Abb.: (5)Spectrogram, FFT size 512, Hanning window
© 2008 Thorsten Mahn (684)
Sonagramm vergleichen:
D. auratus ist ein tagaktiver, ruhiger manchmal etwas scheuer Frosch. Varianten von der Karibikseite der mittelamerikanischen Landbrücke scheinen etwas weniger scheu, als die Varianten der Pazifikseite (BIRKHAHN ET AL., 1994). Möglicherweise ist dieser Unterschied im Verhalten ein angeborener Bestandteil des Verhaltensrepertoires, der mit den klimatisch unterschiedlichen Bedingungen der beiden Küstenseiten einhergeht. Da Varianten der Pazifikseite in den Monaten Januar bis April einer Trockenperiode ausgesetzt sind, leben die Tiere zu dieser Zeit sehr versteckt. Sie ziehen sich tief unter Baumwurzeln oder in Gesteinsspalten zurück. An Stellen von Restfeuchte finden sich während der Trockenperiode oft größere Ansammlungen mehrere Tiere (BIRKHAHN, pers. Komm.). Auch in der übrigen Zeit des Jahres leben pazifische Varianten versteckter und sind meist nur in den frühen Morgen- und späten Nachmittagstunden außerhalb ihrer Verstecke zu beobachten. Während der regenarmen Monate stirbt in vielen Biotopen auch die Bodenvegetation ab und der Sichtschutz fehlt somit. Eine versteckte Lebensweise erscheint somit auch im Hinblick auf Beutegreifer sinnvoll. Nach Regengüssen sind vermehrt Tiere im Biotop zu finden. Auch im Terrarium sind die Tiere nach der Beregnung besonders aktiv und lassen sich dann auch eher beobachten. Die Varianten der Karibikseite sind keiner Trockenperiode ausgesetzt und im Biotop den ganzen Tag über anzutreffen. Diese Varianten zeigen sich im Terrarium sehr viel weniger scheu. Aber auch die Terrariengröße und Einrichtung scheint einen Einfluss auf das Verhalten zu haben. Eine Gruppe der als besonders scheu geltenden blauen Variante von Calobre lebt beim Autor in einem 60 cm x 50 cm x 60 cm großen, dicht bepflanzten Terrarium und die Tiere sind immer zu sehen und reagieren auch auf Störungen kaum. Sie entstammen allerdings auch einer "weniger scheuen" Linie von MARTENS, Cuxhaven. Die Tiere seiner Linie sind bei allen dem Autor bekannten Haltern sehr gut zu beobachten! (OSTROWSKI, pers. Beobachtung).
Revierverhalten:
Die Tiere bilden je nach Variante mehr oder weniger stark ausgeprägte Reviere. Tiere der Karibikseite findet man sehr oft paarweise an immer denselben Stellen wie z.B. am Fuß der Wanderpalme (Abb.12) oder der großen Brettwurzelbäume (OSTROWSKI, pers. Beobachtung). Sie scheinen äußerst standorttreu und benutzen immer wieder dieselben Routen bei der Revierdurchquerung (BECKER, pers. Komm.). Nach WELLS (1978) sind die Männchen jedoch wenig territorial und aggressive Interaktionen sind nur selten im Freiland zu beobachten. Dennoch kommen sowohl im Freiland und im Terrarium Kämpfe vor. WELLS berichtet von aggressivem Verhalten zwischen zwei Männchen der Kanalzone-Variante auf Barro Colorado. Dabei handelte es sich jedoch nicht um einen Revierkampf, sondern um einen Kampf um ein umworbenes Weibchen. Aggressives Verhalten zwischen Weibchen konnte von ihm im Freiland nicht beobachtet werden. Im Terrarium beobachtet man jedoch auch zwischen Weibchen Ringkämpfe, wenn zwei Tiere um ein rufendes Männchen konkurrieren. Auch wurden bereits Weibchen im Terrarium beobachtet, die Eier aus fremden Gelegen fraßen. (WELLS, 1978 und OSTROWSKI, pers. Beobachtung). Allerdings ist die aggressive Verhaltensweise nicht weibchenspezifisch, sondern scheint eher vom Operationellem Geschlechterverhältnis, dem OSR (operational sex ratio), abzuhängen. Dieses beschreibt das Verhältnis der fortpflanzungsbereiten verfügbaren Geschlechtspartner zueinander. Im Terrarium kommt es zu Ringkämpfen unter Weibchen denen nur ein Männchen zugesellt ist (WELLS, 1978). Das OSR ist also zur Weibchenseite verschoben. Ebenso können aber auch Ringkämpfe zwischen Männchen bei Konkurrenz um ein einziges Weibchen beobachtet werden, also wenn das OSR auf die Männchenseite verschoben ist (OSTROWSKI, pers. Beobachtung). Weibchen von D. auratus sind insgesamt also nicht aggressiver als Männchen. Die aggressiven Verhaltensweisen betreffen meist nur die direkten Balzhandlungen. Ansonsten ist D. auratus wenig aggressiv und territorial und lässt sich deshalb gut in Gruppen halten, in denen sich dann eine Rangordnung ausbildet.
Balzverhalten:
Ausführlich beschreibt WELLS (1978) das Balzverhalten von D. auratus. Dabei spielt das Weibchen die aktivere Rolle. Erreicht ein paarungsbereites Weibchen ein rufendes Männchen beginnt es, dieses mit den Vorderfüßen abwechselnd zu berühren (s. Abb.5 u. 6). Dieses „Streicheln“ wird oft am Hinterleib des Männchens ausgeführt (OSTROWSKI, pers. Beobachtung). Erreicht das Weibchen das Männchen von einer anderen Seite, so wird aber auch an anderen Körperstellen gestreichelt. WELLS beschreibt ein Streicheln von der Kopfseite her. Ist auch das Männchen in Paarungsstimmung so hüpft es nun dem Weibchen voraus, wobei es auch hin und wieder ruft, falls das Weibchen nicht sofort folgt oder außer Sicht gerät. Normalerweise folgt das Weibchen dem Männchen aber sofort, ohne durch weiteres Rufen stimuliert werden zu müssen. Nun bewegt sich das Paar, unterbrochen von weiteren Berührungspausen, durch das angestammte Revier in Richtung Eiablagestelle. WELLS berichtet von einem Besteigen des Männchens durch das Weibchen. Auch der Autor konnte solches Verhalten beobachten. Dabei klettert das Weibchen rückwärts auf den Rücken des Männchens (s. Abb.7). Ein anderes Berührungsverhalten ist das Kinnstemmen, wobei das Weibchen dem Männchen die Schnauze unter das Kinn drückt. Auch eine Stellung, in der beide Partner Schnauze an Schnauze sitzend verharren, kann beobachtet werden. Bei all diesen Berührungsritualen spielt das Weibchen die aktivere Rolle. Männchen sind oft sehr passiv und bei eingespielten Paaren im Terrarium kann eine erfolgreiche Balz ablaufen, ohne dass das Männchen einen einzigen Ruf abgibt (OSTROWSKI, pers. Beobachtung). Der Laichplatz wird jedoch vom Männchen gewählt. Die Balz kann bis zu 2 h dauern (WELLS, 1978). Dabei untersucht das Männchen mehrere in Frage kommende Ablaichstellen, bis es sich für eine entscheidet. Im Terrarium werden besonders gerne waagerecht angebrachte Fotodosen oder sog. Laichhäuschen benutzt (Petrischale mit Kokosnuss überdacht). In Freiland laichen sie auf glatten Blättern in der Laubschicht (WELLS, 1978). Hat das Paar den Laichplatz erreicht erfolgt die Paarung. Dabei sitzen die Tiere nebeneinander und es kommt zu keinem Amplexus. Das Männchen verteilt unter wischenden Bewegungen sein Sperma mit Blasenflüssigkeit auf der Unterlage ab und verlässt den Laichplatz. Nun legt das Weibchen seine Eier auf die befeuchtete und besamte Unterlage und verlässt danach ebenfalls den Ablageort. Das hier beschriebene Verhalten mit Körperstreicheln und getrennter Abgabe der Eier und Spermien ohne einen ist typisch für alle Vertreter der Unterfamilie Dendrobatinae.
 Abb.5: Pärchen bei der Balz. Rechts das Männchen. © 2005 I. Meuche |
 Abb.6: Vorderbein-Körperstreicheln durch das Weibchen (links). Nach WELLS, 1978. |
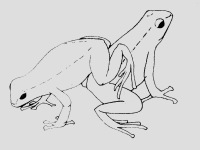 Abb.7: Rückwärtiges Besteigen durch das Weibchen (links). Nach WELLS, 1978. |
 Abb.: Dendrobates auratus "Karibikseite" bei der Balz © 2008 Gert Benaets |
 Abb.: Das Pärchen hat sich an eine Geschützte Stelle im Laub zurück gezogen, um ein Gelege abzusetzen © 2008 Gert Benaets |
Brutpflegeverhalten:

Abb.8: Larventragendes Männchen. © 2005 Ivonne Meuche

Abb.9: Natürliche und künstliche Absatzstellen für Larven von D.auratus. © 2005 T. Ostrowski
Das Männchen setzt die Larven meist in Baumhöhlen ab. Aber auch andere ta, wie z.B. wassergefüllte Bromelienachseln werden benutzt. Dabei klettern Männchen durchaus höher an Bäumen hinauf. Männchen sind nicht wählerisch bei der Auswahl der Absatzgewässer. Auf Taboga konnten Quappen in künstlichen Kleinstgewässern in Autoreifen, Plastikplanen, alten Farbeimern, Blechdosen und Gläsern (s. Abb.9) nachgewiesen werden (OSTROWSKI, pers. Beobachtung). Oft benutzen Männchen für ihre Gelege immer wieder die gleichen Absatzstellen. Bei Mangel an Wasseransammlungen setzen alle Männchen eines Gebietes ihre Larven im Extremfall in nur einer einzige Wasserstelle ab. Man findet in solchen Wasseransammlungen dann viele Larven in unterschiedlichen Entwicklungsstadien. Bei Futtermangel kommt es in solch stark besetzten Wasseransammlungen zu Kannibalismus unter den Larven. Männchen können mehrere Gelege gleichzeitig betreuen. Diese Brutverschränkung kommt auch bei anderen Dendrobates Arten vor (JUNGFER, 1985). WELLS (1978) berichtet von einem Männchen das gleichzeitig 2 Gelege mit ca. 10 Tagen Abstand betreute.
Lautäußerung (Vokalisation):
Der Ruf ist ein niederfrequenter leiser (buzz-call) von ca. 2-4 s Sekunden Länge (bis 6 s bei eigenen Messungen, OSTROWSKI). Die Männchen rufen meist von versteckten Plätzen unter Blättern oder Wurzeln, und unregelmäßig über den Tag verteilt. Gleiches gilt für die Brutsaison, in der es auch keine favorisierten Zeiten gibt (WELLS, 1978). Meist rufen die Männchen erst, wenn Weibchen in Sicht kommen oder sogar erst wenn diese durch das typische "Streicheln" versuchen das Männchen paarungsbereit zu stimmen (OSTROWSKI, pers. Beobachtung).
Sound: Anzeigeruf von Dendrobates auratus. © 2006 T. Mahn

Abb.: (5)Spectrogram, FFT size 512, Hanning window
© 2008 Thorsten Mahn (684)
Sonagramm vergleichen:
| Lebensraum | Einklappen |
Typenfundort der Erstbeschreibung
Daten von OpenStreetMap - Veröffentlicht unter CC-BY-SA 2.0
Biotop:
Klima:
Isla Taboga, Bahia de Panama, Panama.
Verbreitung: | 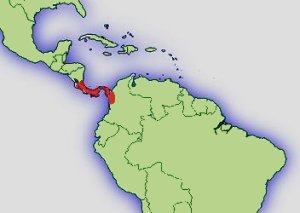 Abb.: (5)Verbreitungsgebiet Dendrobates auratus © 2008 Thorsten Mahn (684) |
Biotop:
D. auratus ist ein äußerst anpassungsfähiger Frosch, der sowohl unberührte Wälder bewohnt, als auch in von Menschen veränderten Landschaften sein Auskommen findet. Ursprünglich ist er ein Bewohner der Laubschicht der tropischen Tiefland- und Bergregenwälder in 5-1450 m Höhe (Abb.12-15). In trockeneren Landstrichen bleibt sein Vorkommen auf die Galeriewälder entlang der Flüsse beschränkt. In der heute zum Teil stark veränderten Weidelandschaft auf der Pazifikseite Costa Ricas und Panamas, ist sein Vorkommen auf Waldinseln und Galeriewälder an Flüssen beschränkt (Abb.16-17). Er kommt aber auch in Gärten, Parkanlagen und extensiv bewirtschafteten Pflanzungen gut zurecht, so lange feuchte Rückzugsmöglichkeiten und ausreichend kleine Wasseransammlungen für die Brut zu finden sind. Eine stabile Population lebt direkt in der Millionenmetropole Panama City auf einem bewaldeten Hügel im Herzen der Stadt. Im Bereich menschlicher Siedlungen sind Populationen oft erstaunlich individuenstark. Bei der kleine Stadt Santa Fé in der Provinz Veraguas fanden wir in einer kleinen Müllkippe an einem Fluss bis zu 20 Tiere auf etwa 100 qm. In den Kunststoffschalen und Blechdosen des Mülls sammelte sich Wasser und somit waren deutlich mehr Brutmöglichkeiten vorhanden, als natürliche ta in einem Primärwaldstück vorkommen können. Nicht die Nahrungsresourcen, sondern die Anzahl an Brutmöglichkeiten scheint die Populationsgröße zu bestimmen. Ähnliches konnte der Autor in Kakaopflanzungen beobachten, in denen die alten Schalen der Früchte liegen blieben und mit Wasser gefüllt als Larvengewässer dienten. Populationen sind in solchen kleinen extensiven Kakaopflanzungen deutlich individuenstärker als Populationen im angrenzenden Wald. PRÖHL (2002) konnte solch einen Einfluss der Brutgewässer- und Habitatstruktur auf die Populationszusammensetzung bei Oophaga pumilio nachweisen. Die individuenstärkste Population konnte der Autor auf der Isla Taboga in der Bahía de Panamá siedlungsnah beobachten. Hier konnten große Mengen an Quappen in alten Farbeimern, Folien und aufgeschnittenen Kanistern nachgewiesen werden (s. Abb.9) und auch Adulte sind in großer Zahl im Wald am Rande der Siedlung zu finden. Im natürlichen Wald findet sich eine deutlich geringere Populationsdichte. Auf der Karibikseite finden sich die Tiere im natürlichen Biotop meist zwischen den Wurzeln großer Bäume. Von hier aus erkunden sie den Waldboden in der Umgebung, kehren aber regelmäßig in den Schutz der Wurzeln zurück. Eine pazifische Population konnte bei Dominical in Costa Rica beobachtet werden, wo sie ebenfalls in der Laubschicht zwischen Steinen und Wurzeln entlang eines kleinen Baches zu finden waren. Sind keine natürlichen Baumhöhlen vorhanden, klettern die Tiere auch in die Baumkronen um epiphytische Bromelien als Larvenabsatzstelle zu nutzen. Es wurden bereits Tiere in 45 m Höhe nachgewiesen (SAVAGE, 2002).
Klima:
Aufgrund seines großen Verbreitungsgebietes, von Nicaragua bis an die Westküste von Kolumbien bei vertikaler Verbreitung von 5 – 1450 m Höhe, bewohnen die verschiedenen Varianten auch klimatisch recht unterschiedliche Gebiete. Die kolumbianischen Varianten kommen in Kolumbien in einem der niederschlagreichsten Gebiete der Erde vor. Die Regenmengen erreichen bis zu 7000 mm im Jahr (Durchschnitt Deutschland ca. 700 mm). Die Länder Nicaragua, Costa Rica und Panama werden durch die von Nordwest nach Südost verlaufenden vulkanischen Gebirgsketten, den Kordilleren, in eine trockenere Pazifik- (1000-2500 mm Jahresniederschlag) und feuchte Karibikseite (3000-4500 mm Jahresniederschlag) getrennt (Abb.18 u. 19). Bedingt durch den Regenschatten der Kordilleren und den unterschiedlich stark wehenden Passatwinden , kommt es auf der Pazifikseite von Dezember bis April zu einer Trockenperiode. Auf deren Höhepunkt von Januar bis April fällt meist weniger als 100 mm Niederschlag im Monat (Abb.19). Es kommt zu einer Trockenzeit. In den besonders trockenen Gebieten (z.B. Santa Rosa Nationalpark, Costa Rica) kommt es zu einem Vegetationsrückgang. Hier gibt es keine immerfeuchten Regenwälder mehr, sondern Laub abwerfende Trockenwälder bestimmen die Landschaft. Amphibien überleben hier nur an ständig Wasser führenden Flüssen aus den regenreichen Kordilleren oder durch eine Sommerruhe.
Pfeilgiftfrösche kommen in Mittelamerika in Gebieten unter 1200 mm Jahresniederschlag nicht mehr vor. Auch die vertikale Verbreitung von 5-1450 m Höhe bedingt recht unterschiedliche Klimabereiche. Während in der Laubschicht des Tieflandregenwaldes recht konstante Temperaturen von 25-26°C herrschen, sinkt die mittlere Jahrestemperatur auf 1400 m Höhe, im Nebelwald bei El Copé, auf 18°C. Die Jahresdurchschnitts- temperatur sinkt nach WALTER & BRECKLE (1999) in den Tropen etwa alle 200 m um 1,2°C. Auch die Niederschlagsmenge und Luftfeuchtigkeit durch Wolkenbildung steigt mit zunehmender Hohe an. Pazifische Gebiete der Hochlagen erhalten dadurch auch in den Trockenmonaten noch wesentlich mehr Niederschläge als die Tieflagen in denen sich die Trockenperiode voll auswirkt, und manchmal mehrere Wochen kein Regen fällt. Das tropische Klima zeichnet sich durch geringe Temperaturschwankungen im Jahresverlauf aus (ca. 1-2 °C). Im Tagesverlauf gibt es aber wesentlich höher Schwankungen. Im Tag-Nacht Rhythmus kann es zu Temperaturunterschieden von bis zu 10° C kommen. Auch diese Tagesrhythmik wird mit zunehmender Höhe deutlicher während der Tag-Nacht Unterschied im Tiefland meist nur 1-2 °C beträgt (WALTER & BRECKLE, 1999). Eine genaue Kenntnis der Fundorte und eine Anpassung der klimatischen Verhältnisse ist für eine erfolgreiche Haltung deshalb sehr nützlich. Zwar ist D. auratus sehr anpassungsfähig und alle Varianten können bei mittleren Werten um 24° C gut gehalten werden, aber eine möglichst naturnahe und damit artgerechte Haltung sollte das Ziel eines jeden Terrarianers sein.
 Abb.: Rio San Felix wärend der Trockenzeit... © 2006 Michael Isensee |
 Abb.: ... und das selbe Gewässer zur Regenzeit © 2008 Thomas Ostrowski |
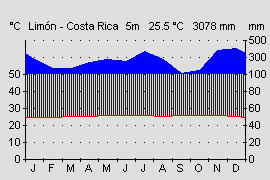 Abb.18: Klimadiagramm der Atlantikseite. Costa Rica, Provinz Limón. Quelle: Instituto Geografico Nacional de Costa Rica. © 2005 T. Ostrowski | 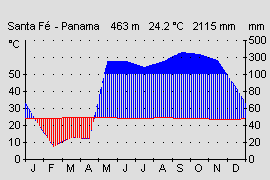 Abb.19: Klimadiagramm der Pazifikseite. Panama, Provinz Veraguas. Quelle: Instituto Geografico Tommy La Guardia. © T. Ostrowski |
| Haltung im Terrarium | Einklappen |
Terrarium/Einrichtung:
Temperaturen:
Luftfeuchte:
Ernährung:
Besatz:
Tipps zur Zucht:
Varianten in Terrarienhaltung:
ab 50cm x 50cm x 50cm. Automatische und sind empfehlenswert. Als Einrichtung bieten sich Brenntorfziegel, Steine und an. Für die Fortpflanzung wird ein angeboten. Als Beflanzung kommen Javamoos, Bromelien und diverse Rankflanzen zum Einsatz.
Temperaturen:
Für Tieflandvarianten 24-26 °C mit geringer Nachtabsenkung von 1-2 °C. Varianten aus höheren Lagen 20-24 °C mit etwas stärkerer Nachtabsenkung von 3-5 °C. Für pazifische Varianten Trockenperiode in den Monaten Januar bis April mit leicht erhöhter Temperatur (27 °C) und weniger Beregnung. Temperaturen von 18 °C werden für einige Zeit problemlos überstanden. Konstante Temperaturen über 28 °C sind auf Dauer schädlich.
Luftfeuchte:
75-85%, zur Mittagszeit Abfall auf 70%, morgens und abends annähernd 100% (Nebel). Pazifikvarianten in Trockenperiode bei nur 60-70% Luftfeuchte halten.
Ernährung:
Übliche kleine und mittlere Futtertiere: kleine und große , Mikro-Heimchen (bis 5 mm), , Wiesenplankton. Gerne werden etwas größere Beutetiere wie und Raupen der Wachsmotte genommen. In der Natur überwiegend tropische Ameisen (ca. 80%), heimische Ameisen werden aber nicht gerne genommen (Ameisensäure).
Besatz:
In ausreichend großen Terrarien ist eine Gruppenhaltung möglich. Das Verhalten lässt sich aber am besten an einzelnen, ungestörten Paaren beobachten. Für eine Zucht ebenfalls am besten 1,1.
Vergesellschaftung mit nah verwandten Arten wie D. tinctorius und D. leucomelas vermeiden, da es zu Bastardisierungen zwischen den Arten kommen kann. Dagegen ist eine Vergesellschaftung mit O. pumilio in ausreichend großen Terrarien möglich. Hier bei muß das Verhalten der Tiere regelmäßig beobachtet werden. Sollte es zu Unterdrückungsritualen müssen die Tiere getrennt werden.
Tipps zur Zucht:
Die Eiablage erfolgt an geschützten glatten Stellen (Petrischale unter Kokosnuss, Filmdose). Einzelhaltung der Quappen empfehlenswert (kannibalisch veranlagt). Die Wassertemperatur bei der Larvenaufzucht sollte langfristig 26°C nicht über- und 17°C nicht unterschreiten. Nachtabsenkung der Temperatur empfohlen. Quappen sind (s.o. bei Larven). Ernährung mit Zierfischtrockenfutter. Regelmäßiger 100%iger Wasserwechsel spätestens alle 14 Tage. Die Aufzucht der Jungtiere ist bei guter Fütterung ohne Probleme in Gruppen möglich.
Varianten in Terrarienhaltung:
| Alto de Piedra |  |
| Altos de Campana |  |
| Bahia Solano |  |
| Bronce |  |
| Caldera |  |
| Calobre |  |
| Campana |  |
| Capira |  |
| Carara |  |
| Carpurganá |  |
| Chocó |  |
| Colón |  |
| El Copé |  |
| El Oro |  |
| El Real |  |
| Hawaii |  |
| Holotyp |  |
| Karibikseite |  |
| Karibikseite (Cahuita) |  |
| Karibikseite (Rambala) |  |
| Karibikseite (Río La Gloria) |  |
| Karibikseite (Tierra Oscura) |  |
| Kuna Yala |  |
| Lago Bayano |  |
| Los Planes |  |
| Meteti |  |
| Pastores |  |
| Pazifikseite |  |
| Peña Blanca |  |
| Portobelo |  |
| Punta Pequeña |  |
| Restingue |  |
| San Felix |  |
| Santa Maria |  |
| Zona Canal |  |
Daten errechnet aus von Nutzern gemeldeten Fröschen (Home->Meine Frösche) und den aktuellen Inseraten.
stand 27.01.2026 18:40 Uhr
stand 27.01.2026 18:40 Uhr
| Autoren dieser Seite: | Einklappen |
| Referenzen | Einklappen |
BIRKHAHN, H., KÜLPMANN, V. & K. WASSMANN (1994): Zur Variabilität des Goldbaumsteigers.
XX- Aquar.Terrar.Zeitschr. 47 (9): 570-576
CITES (2005): Convention on International Trade of Endangered Species of Wild Fauna and Flora.
XXOnlineversion: 11.08.05. Electronic Database accessible at http://www.cites.org/index.html
DALY, J.W., SECUNDA, S.I., GARRAFTO, H.M., SPANDE, T.F., WISNIESKI, A. & J.F. COVER JR (1994):
XXAn uptake system for dietary alkaloids in Poison Frogs (Dendrobatidae). - Toxicon 32 (6): 657-663
DALY, J.W., SECUNDA, S.I., GARRAFTO, H.M., SPANDE, T.F., WISNIEWSKI, A. , NISHIHIRA, C.
& J.F. COVER JR (1992): Variability in alkaloid profiles in neotropical Poison Frogs (Dendrobatidae):
XXGenetic versus environmental determinants. - Toxicon 30 (8): 887-898
FINCHE, O.M., YANOVIAK, S.P. & R.D. HANSCHU (1997): Predation by odonates depresses mosquito
XXabundance in water-filled tree holes in Panama. – Oecologica 112: 244-253
FROST, D.R. (2007): Amphibian Species of the World: an Online Reference. Version 5.0 (1.02.2007).
XXElectronic Database accessible at http://research.amnh.org/herpetology/amphibia/index.php
XX Am.Mus.Nat.Hist. New York, USA.
GIRARD, C. (1855): Abstract of a report to Lieut. J.M. Gillis, U.S.N., upon the reptiles collected during
XXU.S.N. astronomical expedition to Chili. - Proc.Acad.Nat.Sci.Phil 7: 226-227.
GOSNER, K.L. (1960): A Simplified Table for Staging Anuran Embryos and Larvae.
XX-Herpetologica, 16: 183-190
GRANT, T . , FROST, D. R. , CALDWELL, J. P. , GAGLIARDO, R. , HADDAD, C. F. B. , KOK, P. J. R. ,
XXMEANS, D.B. , NOONAN, B. P. , SCHARGEL, W. E. & W.C. WHEELER (2006): Phylogenetic
XXsystematics of dart-poison frogs and their relatives (Amphibia, Athesphatanura, Dendrobatidae).
XX - Bulletin of the Am.Mus.Nat.Hist. 299. (PDF)
IUCN, Conservation International, and NatureServe. (2009): Global Amphibian Assessment.
XXwww.globalamphibians.org. Downloaded on 15 October 2004.
MASTER, T.L. (1999): Predation by Rufous Motmot on Black-and-Green Poison Dart Frog
XX- Wilson Bull., 11 l (3): 439-440
SAPORITO, R.A., GARRAFFO, H.M., DONNELLY, M.A. , EDWARDS, A.L., LONGINO, J.T., & J.W. DALY (2004):
XXFormicine ants: An arthropod source for the pumiliotoxin alkaloids of dendrobatid poison frogs.
XX- Proc.Nat.Acad.Sci USA 101 (21):8045-8050
SAVAGE, J.M. (1968): The Dendrobatid Frogs of Central America. - Copeia 1968 (4): 745-776
SAVAGE, J.M. (2002): The Amphibians and Reptiles of Costa Rica. A Herpetofauna between two
XXContinents, between two Seas. - The University of Chigago Press, Chigago.
SILVERSTONE, P.A. (1975): A Revision of the Poison-Arrow-Frogs of the Genus Dendrobates Wagler.
XX- NatHist.Mus. Los Angeles County, Sci.Bull. 21: 1-55. (PDF)
SPANDE T.F., POONAM, J., GARAFFO, H.M., PANNELL, L.K., YEH, H.J.C. & J. DALY (1999): Occurence
XXand significance of Decahydroquinolines from Dendrobatid Poison Frogs and a Myrmecine Ant:
XXUse of 1H an 13C NMR in their conformational analysis. - J.Nat.Prod. 1999 (62): 5-21
SUMMERS, K. (1999): Dendrobates auratus (Green Poison Frog) predation.
XX- Herpetological Rewiew 30 (2): 91
WALTER, H. & S. BRECKLE (1999): Vegetationen und Klimazonen. 7. Auflage. - Ulmer, Stuttgart.
WELLS, K.D. (1978): Courtship and parental behaviour in a Panamanian Poison-Arrow Frog
XX(Dendrobates auratus). - Herpetologica 34 (2): 148-155
YANOVIAK S. P. (2001): The Macrofauna of Water-filled Tree Holes on Barro Colorado Island, Panama.
XX- Biotropica 33 (1): 110–120.
XX- Aquar.Terrar.Zeitschr. 47 (9): 570-576
CITES (2005): Convention on International Trade of Endangered Species of Wild Fauna and Flora.
XXOnlineversion: 11.08.05. Electronic Database accessible at http://www.cites.org/index.html
DALY, J.W., SECUNDA, S.I., GARRAFTO, H.M., SPANDE, T.F., WISNIESKI, A. & J.F. COVER JR (1994):
XXAn uptake system for dietary alkaloids in Poison Frogs (Dendrobatidae). - Toxicon 32 (6): 657-663
DALY, J.W., SECUNDA, S.I., GARRAFTO, H.M., SPANDE, T.F., WISNIEWSKI, A. , NISHIHIRA, C.
& J.F. COVER JR (1992): Variability in alkaloid profiles in neotropical Poison Frogs (Dendrobatidae):
XXGenetic versus environmental determinants. - Toxicon 30 (8): 887-898
FINCHE, O.M., YANOVIAK, S.P. & R.D. HANSCHU (1997): Predation by odonates depresses mosquito
XXabundance in water-filled tree holes in Panama. – Oecologica 112: 244-253
FROST, D.R. (2007): Amphibian Species of the World: an Online Reference. Version 5.0 (1.02.2007).
XXElectronic Database accessible at http://research.amnh.org/herpetology/amphibia/index.php
XX Am.Mus.Nat.Hist. New York, USA.
GIRARD, C. (1855): Abstract of a report to Lieut. J.M. Gillis, U.S.N., upon the reptiles collected during
XXU.S.N. astronomical expedition to Chili. - Proc.Acad.Nat.Sci.Phil 7: 226-227.
GOSNER, K.L. (1960): A Simplified Table for Staging Anuran Embryos and Larvae.
XX-Herpetologica, 16: 183-190
GRANT, T . , FROST, D. R. , CALDWELL, J. P. , GAGLIARDO, R. , HADDAD, C. F. B. , KOK, P. J. R. ,
XXMEANS, D.B. , NOONAN, B. P. , SCHARGEL, W. E. & W.C. WHEELER (2006): Phylogenetic
XXsystematics of dart-poison frogs and their relatives (Amphibia, Athesphatanura, Dendrobatidae).
XX - Bulletin of the Am.Mus.Nat.Hist. 299. (PDF)
IUCN, Conservation International, and NatureServe. (2009): Global Amphibian Assessment.
XXwww.globalamphibians.org. Downloaded on 15 October 2004.
MASTER, T.L. (1999): Predation by Rufous Motmot on Black-and-Green Poison Dart Frog
XX- Wilson Bull., 11 l (3): 439-440
SAPORITO, R.A., GARRAFFO, H.M., DONNELLY, M.A. , EDWARDS, A.L., LONGINO, J.T., & J.W. DALY (2004):
XXFormicine ants: An arthropod source for the pumiliotoxin alkaloids of dendrobatid poison frogs.
XX- Proc.Nat.Acad.Sci USA 101 (21):8045-8050
SAVAGE, J.M. (1968): The Dendrobatid Frogs of Central America. - Copeia 1968 (4): 745-776
SAVAGE, J.M. (2002): The Amphibians and Reptiles of Costa Rica. A Herpetofauna between two
XXContinents, between two Seas. - The University of Chigago Press, Chigago.
SILVERSTONE, P.A. (1975): A Revision of the Poison-Arrow-Frogs of the Genus Dendrobates Wagler.
XX- NatHist.Mus. Los Angeles County, Sci.Bull. 21: 1-55. (PDF)
SPANDE T.F., POONAM, J., GARAFFO, H.M., PANNELL, L.K., YEH, H.J.C. & J. DALY (1999): Occurence
XXand significance of Decahydroquinolines from Dendrobatid Poison Frogs and a Myrmecine Ant:
XXUse of 1H an 13C NMR in their conformational analysis. - J.Nat.Prod. 1999 (62): 5-21
SUMMERS, K. (1999): Dendrobates auratus (Green Poison Frog) predation.
XX- Herpetological Rewiew 30 (2): 91
WALTER, H. & S. BRECKLE (1999): Vegetationen und Klimazonen. 7. Auflage. - Ulmer, Stuttgart.
WELLS, K.D. (1978): Courtship and parental behaviour in a Panamanian Poison-Arrow Frog
XX(Dendrobates auratus). - Herpetologica 34 (2): 148-155
YANOVIAK S. P. (2001): The Macrofauna of Water-filled Tree Holes on Barro Colorado Island, Panama.
XX- Biotropica 33 (1): 110–120.
| Zitierung: | Einklappen |
OSTROWSKI, T. & T. MAHN (2026): Artbeschreibung Dendrobates auratus.
- Dendrobase.de - Eine Online-Datenbank der Familie Dendrobatidae (Anura).
https://www.dendrobase.de/html/D_dendrobates_auratus.html; Stand: Januar 2026
- Dendrobase.de - Eine Online-Datenbank der Familie Dendrobatidae (Anura).
https://www.dendrobase.de/html/D_dendrobates_auratus.html; Stand: Januar 2026
| Link für Website Betreiber: | Einklappen |
Webmaster dürfen Links von Ihren Seiten zur DendroBase erstellen, wenn sie folgende Kriterien erfüllen:
- Die Website enthält weder illegale, rassistische oder sexistische Inhalte
- Das Thema der Website bezieht sich auf Frösche
- Der Link genau wie folgend angegeben verwendet wird:
<a href="https://www.dendrobase.de/html/D_dendrobates_auratus.html" target="_new">Dendrobates auratus (DendroBase.de)</a>
- Die Website enthält weder illegale, rassistische oder sexistische Inhalte
- Das Thema der Website bezieht sich auf Frösche
- Der Link genau wie folgend angegeben verwendet wird:
<a href="https://www.dendrobase.de/html/D_dendrobates_auratus.html" target="_new">Dendrobates auratus (DendroBase.de)</a>
| Fotos | Einklappen |

Dendrobates (5)auratus
"Karibikseite"
(Río La Gloria)
© 2007 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Karibikseite"
(Tierra Oscura)
© 2005 Sabine Hagemann

Dendrobates (5)auratus
Karibikseite
© 2008 Thomas Ostrowski (0)
Dendrobates (5)auratus
"Karibikseite"
(Tierra Oscura)
seltenes Tier mit gelben Zeichnungselementen
© 2005 Thomas Ostrowski (0)
Dendrobates (5)auratus
"Karibikseite"
(Rambala)
© 2005 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Pastores"
(Isla Pastores)
© 2003 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Pastores"
(Punta Gallinazo)
© 2007 Gert Benaets (35)

Dendrobates (5)auratus
"Peña Blanca"
© 2007 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Peña Blanca"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Peña Blanca"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Punta Pequeña"
© 2005 Bernd Pieper (6)

Dendrobates (5)auratus
"Punta Pequeña"
© 2005 Bernd Pieper (6)

Dendrobates (5)auratus
"Bronce"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Bronce"
© 2005 Jens Debuck

Dendrobates (5)auratus
"Bronce"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Bronce"
© 2008 Thorsten Mahn (684)
Dendrobates (5)auratus
"Bronce"
© 2005 Holger Birkhahn

Dendrobates (5)auratus
"Bronce"
© 2003 Thomas Ostrowski (0)
Dendrobates (5)auratus
"Bronce"
© 2005 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Carara"
© 2005 Michael Werner (0)

Dendrobates (5)auratus
"Pazifikseite"
(Quepos)
© 2005 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Pazifikseite"
(Baru)
© 2004 Michael Werner (0)

Dendrobates (5)auratus
"Caldera"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Caldera"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Caldera"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Los Planes"
© 2004 Thomas Ostrowski (0)

Dendrobates (5)auratus
"San Felix"
© 2007 Thomas Ostrowski (0)

Dendrobates (5)auratus
"San Felix"
© 2006 Thomas Ostrowski (0)

Dendrobates (5)auratus "Restingue"
© 2003 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Santa Maria"
eine sehr farbvariable Population
© 2005 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Santa Maria"
© 2007 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Santa Maria"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Alto de Piedra"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Alto de Piedra"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Alto de Piedra"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"El Copé"
© 2003 Holger Birkhahn

Dendrobates (5)auratus
"El Copé"
© 2003 Tina und Franz Bang (0)

Dendrobates (5)auratus
"Calobre"
© 2006 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Calobre"
© 2006 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Calobre"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Calobre"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Capira"
© 2007 Gert Benaets (35)

Dendrobates (5)auratus
"Capira"
© 2007 Gert Benaets (35)

Dendrobates (5)auratus
"Capira"
© 2007 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Capira"
© 2007 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Capira"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Altos de Campana"
© 2007 Marcus Bartelds

Dendrobates (5)auratus
"Zona Canal"
(Soberania)
© 2007 Gert Benaets (35)

Dendrobates (5)auratus
"Zona Canal"
(Camino de Cruce)
© 2006 Michael Werner (0)

Dendrobates (5)auratus
"Zona Canal"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Zona Canal"
(Cerro Ancon)
© 2007 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Zona Canal"
(Cerro Ancon)
© 2007 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Colón"
© 2002 Tina und Franz Bang (0)

Dendrobates (5)auratus
"Taboga"
© 2006 Michael Werner (0)

Dendrobates (5)auratus
"Taboga"
© 2007 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Taboga"
© 2007 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Taboga"
© 2007 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Hawaii"
zur Verfügung gestellt von pumilio.com

Dendrobates (5)auratus
"Lago Bayano"
© 2006 J. van der Meulen

Dendrobates (5)auratus
"Lago Bayano"
© 2006 J. van der Meulen

Dendrobates (5)auratus
"Meteti"
© 2005 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Kuna Yala"
© 2003 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Kuna Yala"
© 2003 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Kuna Yala"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Kuna Yala"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Kuna Yala"
© 2008 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Capurganá", Kolumbien
© 2009 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Capurganá", Kolumbien
© 2009 Thomas Ostrowski (0)

Dendrobates (5)auratus
"Capurganá", Kolumbien
© 2009 Thomas Ostrowski (0)

Dendrobates (5)auratus
"El Valle"
Departamento Chocó
© 2011 Gert Benaets (35)

Dendrobates (5)auratus
"El Valle"
Departamento Chocó
© 2011 Gert Benaets (35)

Dendrobates (5)auratus
"El Valle"
Departamento Chocó
© 2011 Gert Benaets (35)
Dendrobates (5)auratus
"El Oro"
Neue Variante aus Panama ?
© 2005 Ian Rogers
DendroBase.de Version 5 | Impressum | Datenschutzerklärung































